国内第Ⅲ相臨床試験(MR13A9-5)1)
有効性
主要評価項目
- 二重盲検期4週時の平均かゆみNRSスコアのベースラインからの変化量(検証的解析結果)
-
[主要評価項目(主要評価変数)]
二重盲検期4週時における平均かゆみNRSスコアのベースラインからの変化量の調整済み平均値(両側95%信頼区間)は、プラセボ群-1.09(-1.47、-0.70)、コルスバ®群-2.06(-2.45、-1.66)であった。
変化量の群間差の調整済み平均値(両側95%信頼区間)は-0.97(-1.52、-0.42)であり、プラセボ群に対するコルスバ®群の優越性が検証された(p<0.001 vs.プラセボ群、MMRM)。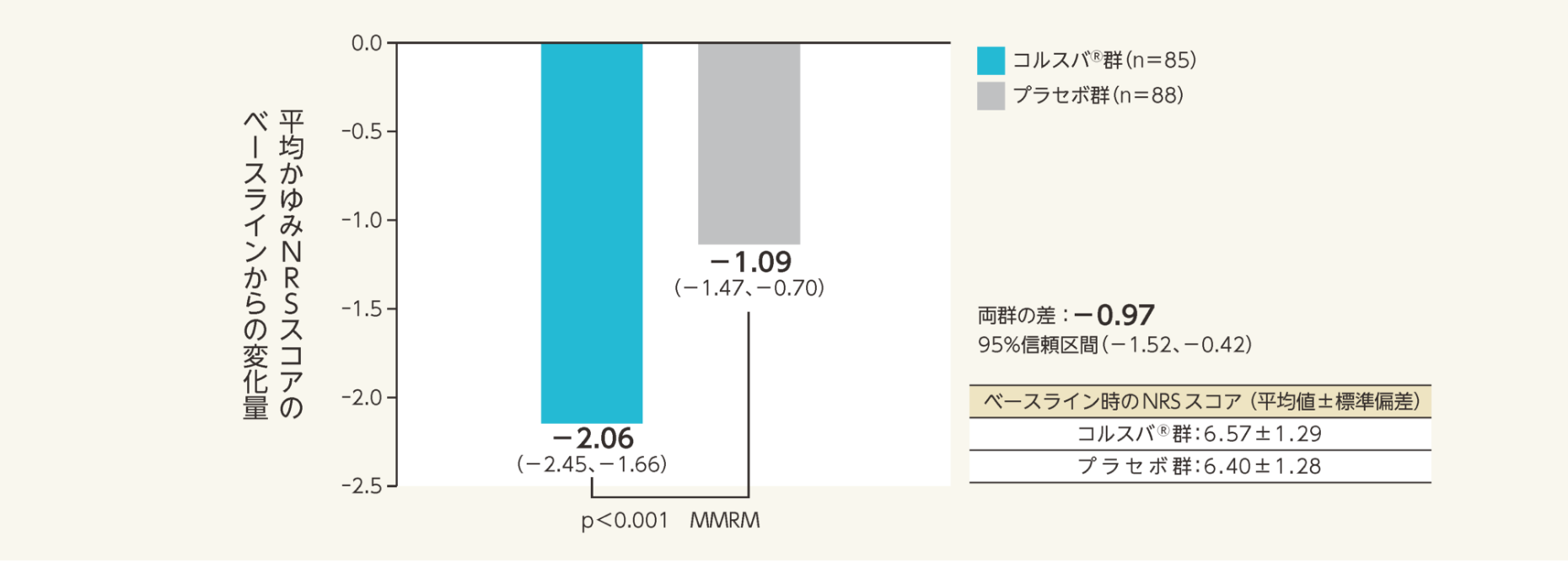
- かゆみに対するNRSスコアを用いて、ベースラインからの変化量について検討した。
- 平均かゆみNRSスコアのベースラインからの変化量を目的変数、投与群、観測時点及び投与群と観測時点の交互作用を固定効果、ベースラインの平均かゆみNRSスコア及び動的割付因子(ナルフラフィン塩酸塩による治療歴の有無)を共変量、被験者を変量効果としたMMRM解析に基づく
平均かゆみNRSスコアのベースラインからの調整済み平均変化量(両側95% 信頼区間)は以下のとおりであった。コルスバ®群は二重盲検期2週から4週時の各評価時点において、プラセボ群と比較し有意差が認められた。
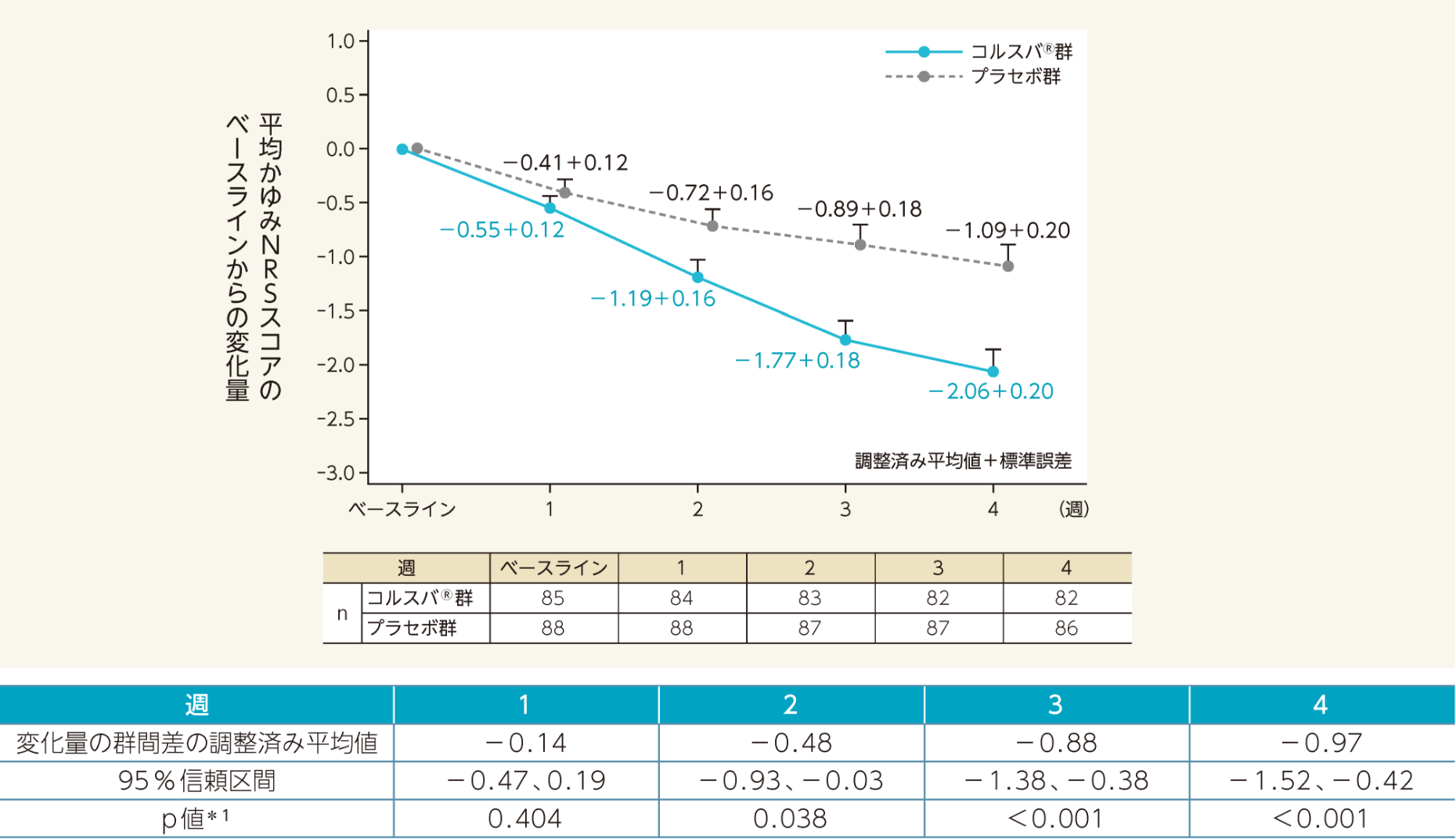 *1:1週~3週時のp値(名目上のp値)、4週時のp値(検証的な解析結果)、MMRM
*1:1週~3週時のp値(名目上のp値)、4週時のp値(検証的な解析結果)、MMRM- かゆみに対するNRSスコアを用いて、ベースラインからの変化量について検討した。
- 平均かゆみNRSスコアのベースラインからの変化量を目的変数、投与群、観測時点及び投与群と観測時点の交互作用を固定効果、ベースラインの平均かゆみNRSスコア及びナルフラフィン塩酸塩による治療歴の有無を共変量、被験者を変量効果としたMMRM 解析に基づく
主要評価項目(その他の評価変数)
- 各評価時点(6週時まで)における平均かゆみNRSスコア
-
[主要評価項目(その他の評価変数)]
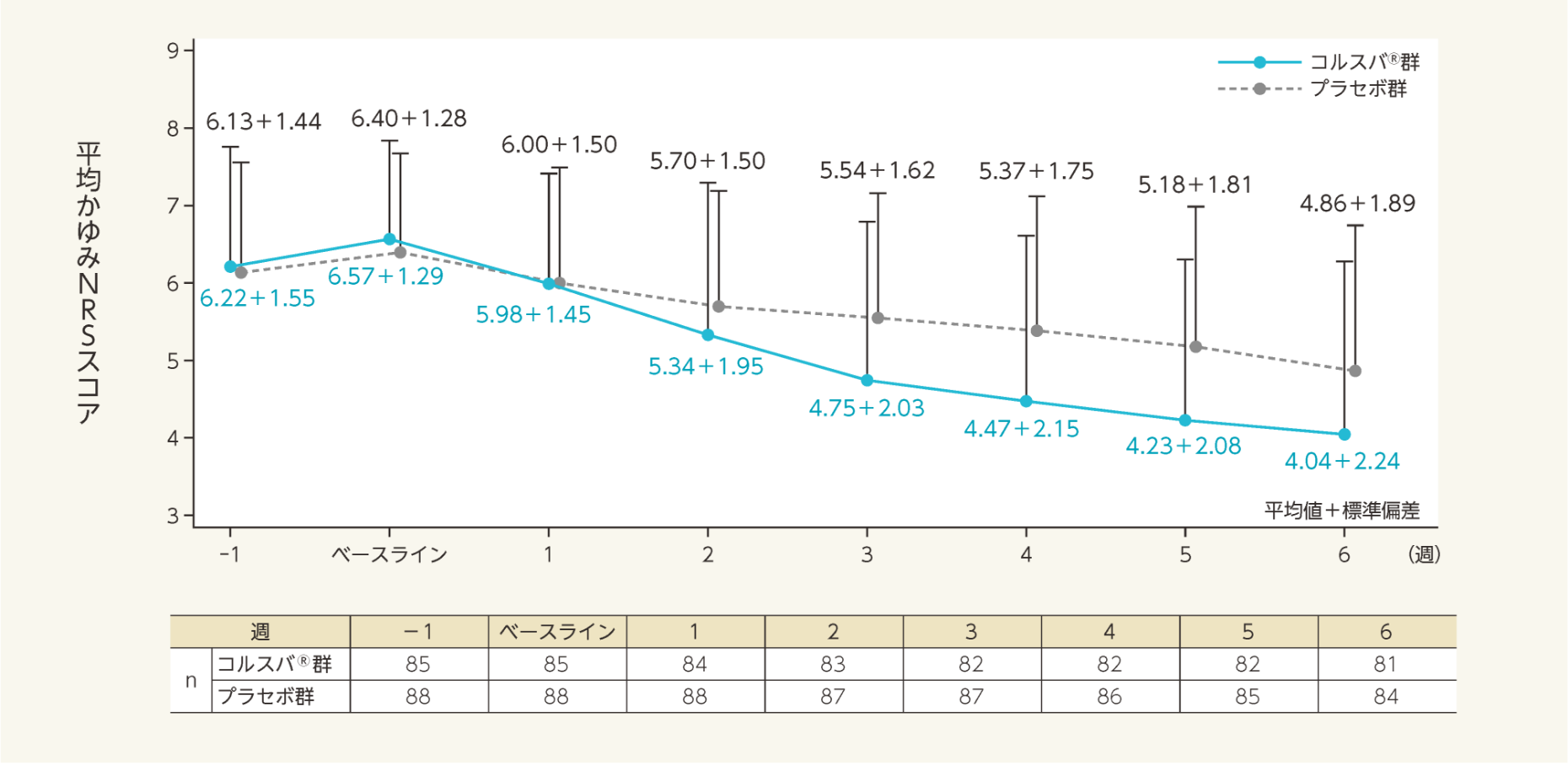
各評価時点における平均かゆみNRSスコアの推移は以下のとおりであった。
- 各評価時点(6週時まで)における平均かゆみNRSスコアのベースラインからの変化量
-
[主要評価項目(その他の評価変数)]
6週時までの平均かゆみNRSスコアのベースラインからの変化量は、以下のとおりであった。コルスバ®群は、投与2週から6週時の各評価時点において、プラセボ群と比較し有意差が認められた。
週 1 2 3 4 5 6 コルスバ®群 n 84 83 82 82 82 81 平均値±標準偏差 -0.58±1.23 -1.23±1.78 -1.81±2.04 -2.09±2.17 -2.34±2.17 -2.53±2.38 プラセボ群 n 88 87 87 86 85 84 平均値±標準偏差 -0.40±1.03 -0.70±1.28 -0.84±1.25 -1.02±1.51 -1.22±1.64 -1.53±1.79 p値*2 0.295 0.025 <0.001 <0.001 <0.001 0.002 *2:名目上のp値、2標本t検定
- かゆみに対するNRSスコアを用いて、ベースラインからの変化量について検討した。
副次評価項目
- 平均かゆみNRSスコア改善率
-
[副次評価項目]
平均かゆみNRSスコアの3点及び4点改善例の割合は、投与1週時から6週時まで以下のグラフのように推移した。3点改善例の割合は投与2週から5週時、4点改善例の割合は投与3週から6週時の各評価時点において、コルスバ®群で有意に増加した。
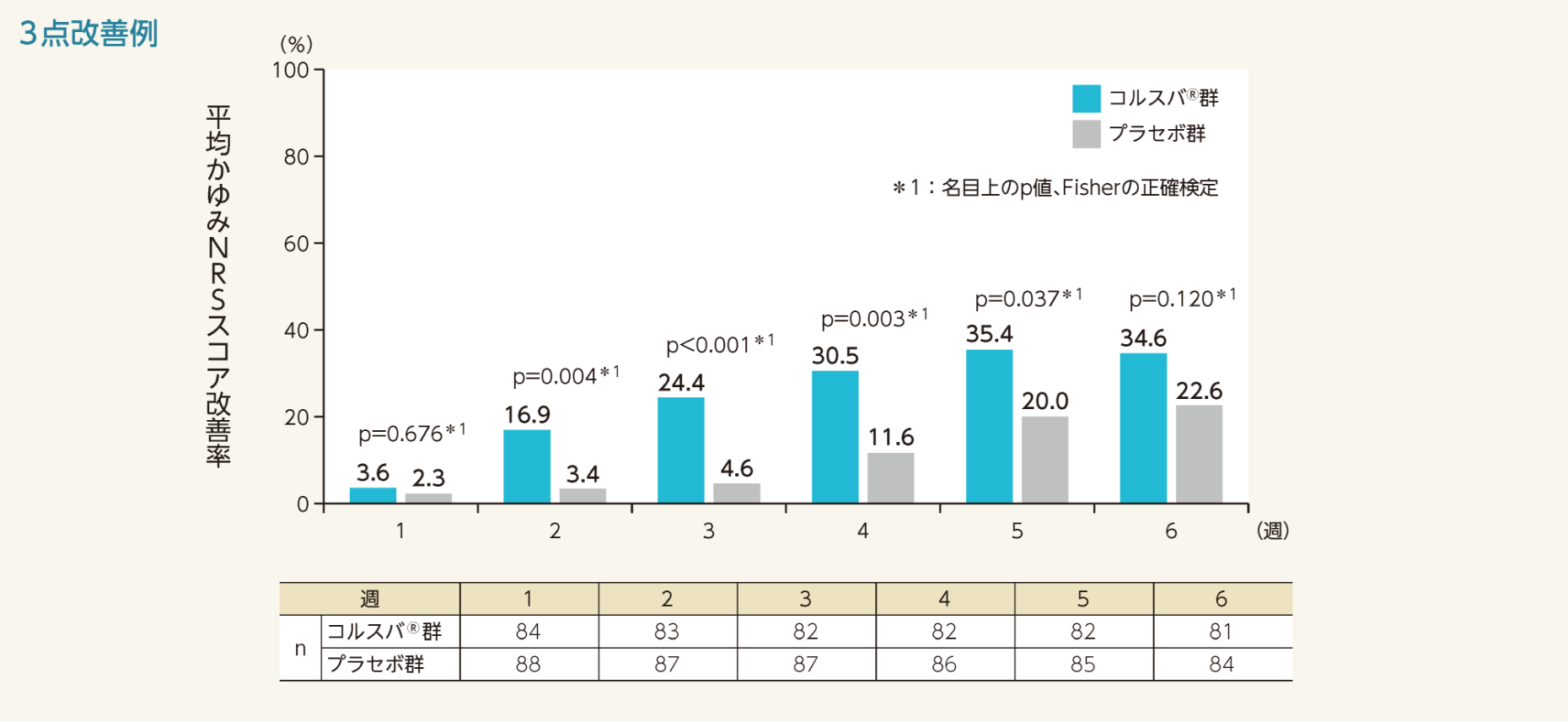
- かゆみに対するNRSスコアを用いて、ベースラインからの変化量が3以下であった症例を3点改善例として、各評価時点における平均かゆみNRSスコア改善率を検討した。
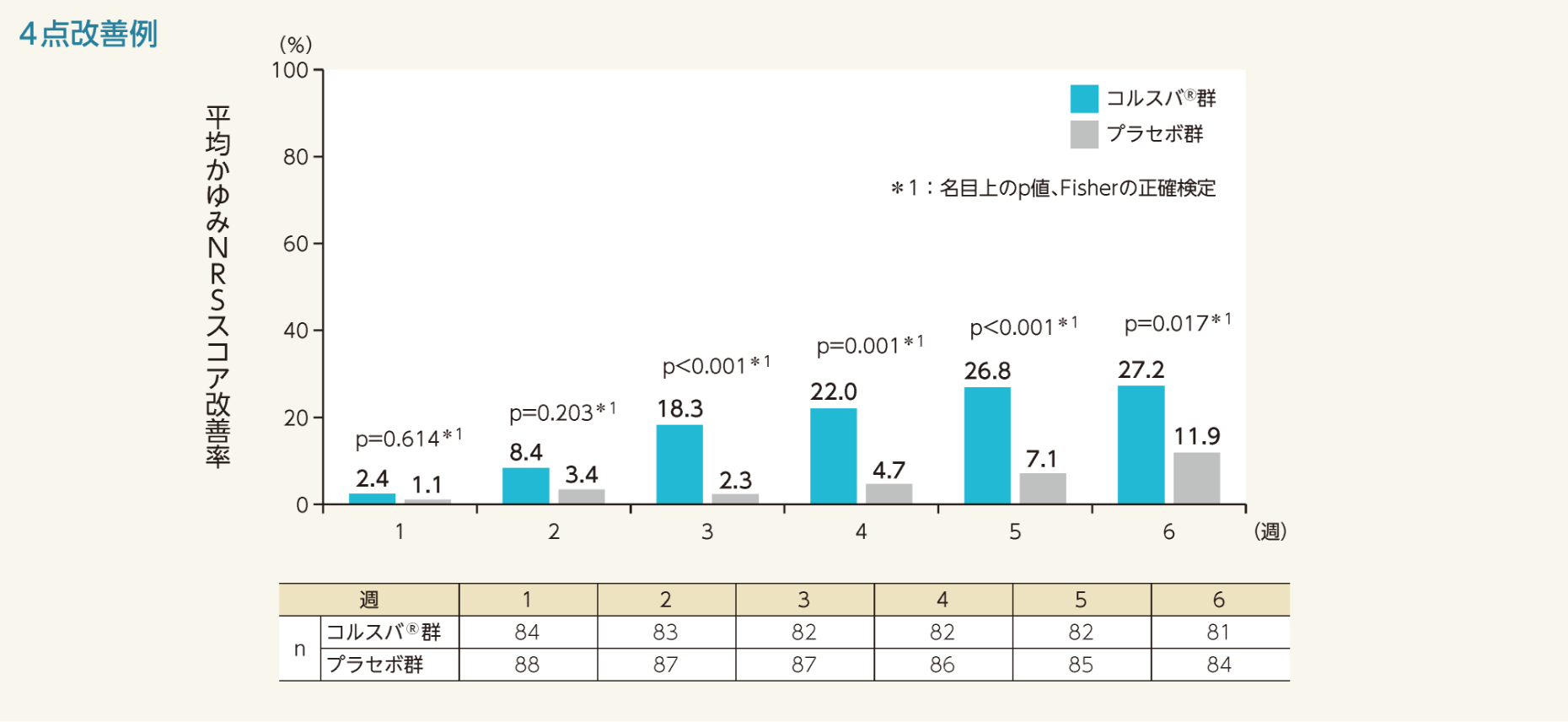
- かゆみに対するNRSスコアを用いて、ベースラインからの変化量が4以下であった症例を4点改善例として、各評価時点における平均かゆみNRSスコア改善率を検討した。
- 各評価時点における白取の重症度基準に基づく平均かゆみスコアのベースラインからの変化量
-
[副次評価項目]
二重盲検期4週時における白取の重症度基準に基づく平均かゆみスコアのベースラインからの変化量の調整済み平均値(両側95%信頼区間)は、プラセボ群-0.42(-0.55、-0.28)、コルスバ®群-0.78(-0.92、-0.64)であった。
変化量の群間差の調整済み平均値(両側95 % 信頼区間)は-0.36(-0.55、-0.17)であり、コルスバ®群は、プラセボ群と比較して有意差が認められた(p<0.001*2 vs.プラセボ群、MMRM)。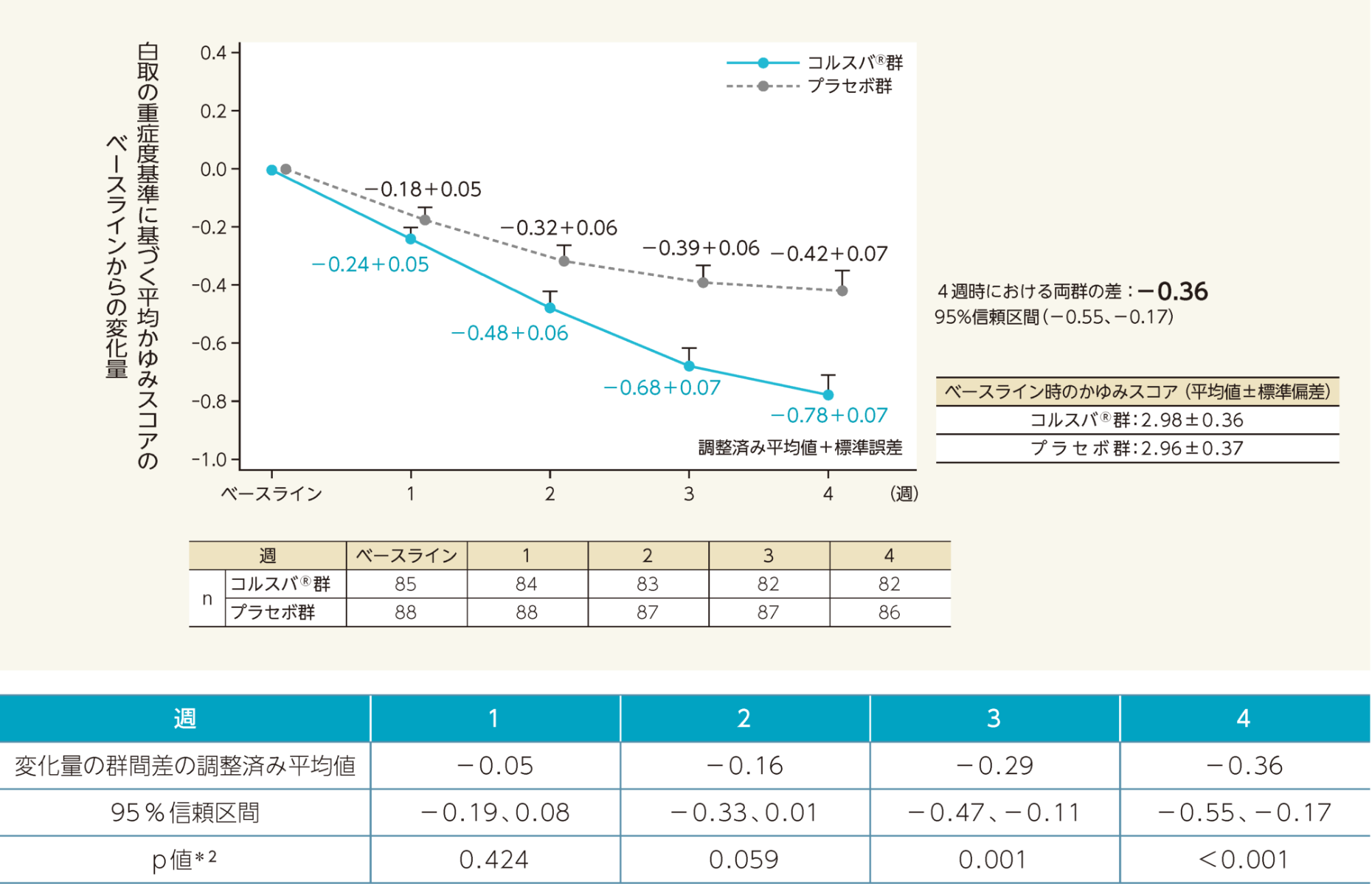
*2:名目上のp値、MMRM
- 白取の重症度基準に基づく平均かゆみスコアを用いて、ベースラインからの変化量について検討した。
- 平均かゆみスコアのベースラインからの変化量を目的変数、投与群、観測時点及び投与群と観測時点の交互作用を固定効果、ベースラインの平均かゆみスコア及びナルフラフィン塩酸塩による治療歴の有無を共変量、被験者を変量効果としたMMRM 解析に基づく
- 二重盲検期最終評価時におけるSkindex-16総合スコアのベースラインからの変化量
-
[副次評価項目]
二重盲検期最終評価時における、そう痒症に関連するQOLの指標となったSkindex-16総合スコアのベースラインからの変化量の調整済み平均値(両側95% 信頼区間)は、プラセボ群-12.51(-15.72 、-9.30)、コルスバ®群-18.48(-21.72 、-15.24)であった。
変化量の群間差の調整済み平均値(両側95%信頼区間)は-5.97(-10.53、-1.41)であり、コルスバ®群はプラセボ群と比較して有意差が認められた(p=0.010*1 vs.プラセボ群、ANCOVA)。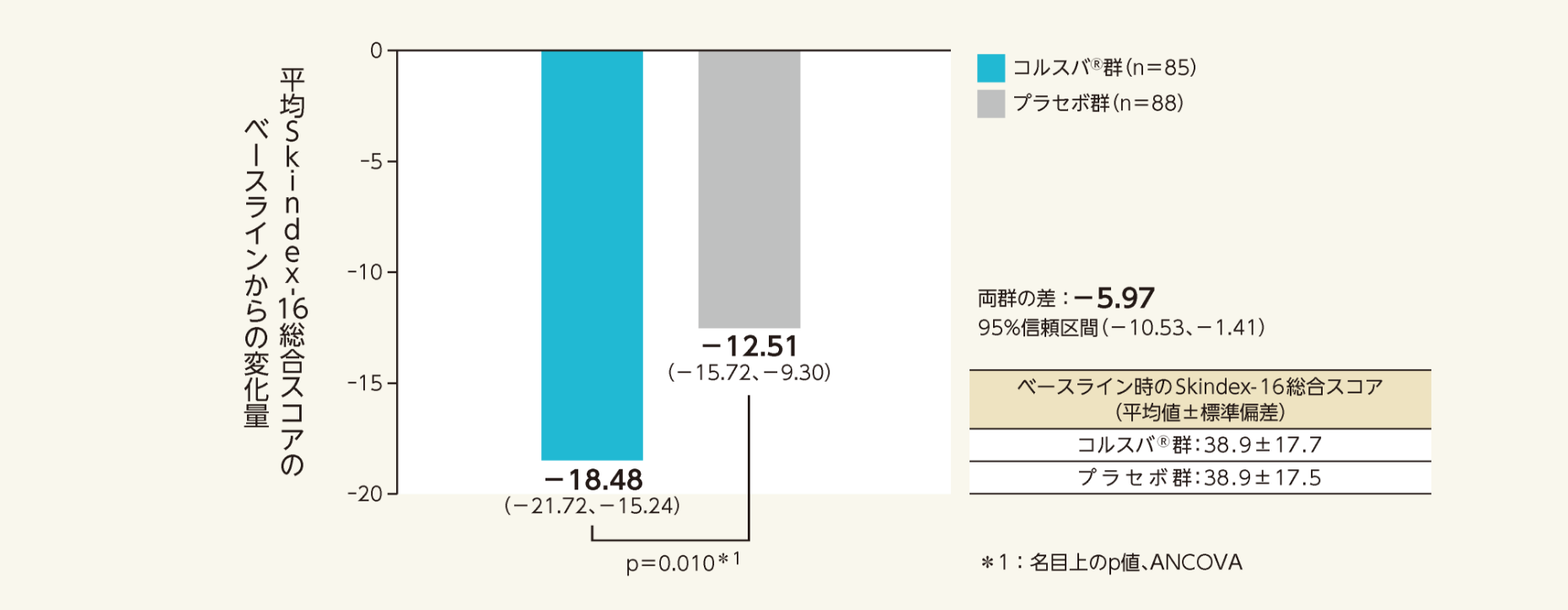
- Skindex-16総合スコアを用いて、ベースラインからの変化量について検討した。
- ベースラインスコアを共変量とした解析に基づく
- 二重盲検期最終評価時における5-D Itch Scale 合計スコアのベースラインからの変化量
-
[副次評価項目]
二重盲検期最終評価時における、そう痒症に関連するQOLの指標となった5-D Itch Scale合計スコアのベースラインからの変化量の調整済み平均値(両側95%信頼区間)は、プラセボ群-2.8(-3.5、-2.2)、コルスバ®群-4.4(-5.1、-3.8)であった。
変化量の群間差の調整済み平均値(両側95%信頼区間)は-1.6(-2.5 、-0.7)であり、コルスバ®群はプラセボ群と比較して有意差が認められた(p<0.001*2 vs.プラセボ群、ANCOVA)。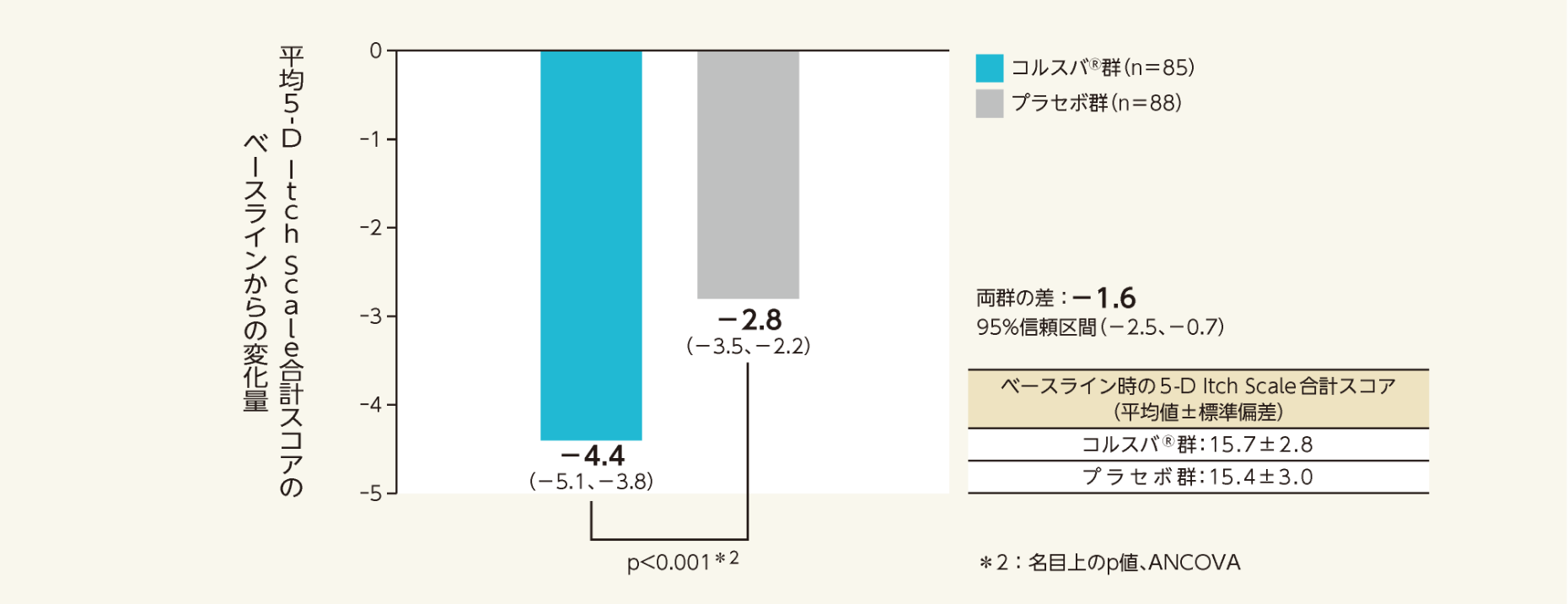
- 5 -D Itch Scale 合計スコアを用いて、ベースラインからの変化量について検討した。
- ベースラインスコアを共変量とした解析に基づく
- 二重盲検期最終評価時におけるPGIC
-
[副次評価項目]
二重盲検期最終評価時における全般的症状の割合は、以下のとおりであった。「良くなった」及び「非常に良くなった」であった患者の割合は、プラセボ群20.9 %に対してコルスバ®群43.5 %であり、コルスバ®群はプラセボ群と比較して有意差が認められた(p=0.001*3 vs.プラセボ群、2標本Wilcoxon検定)。
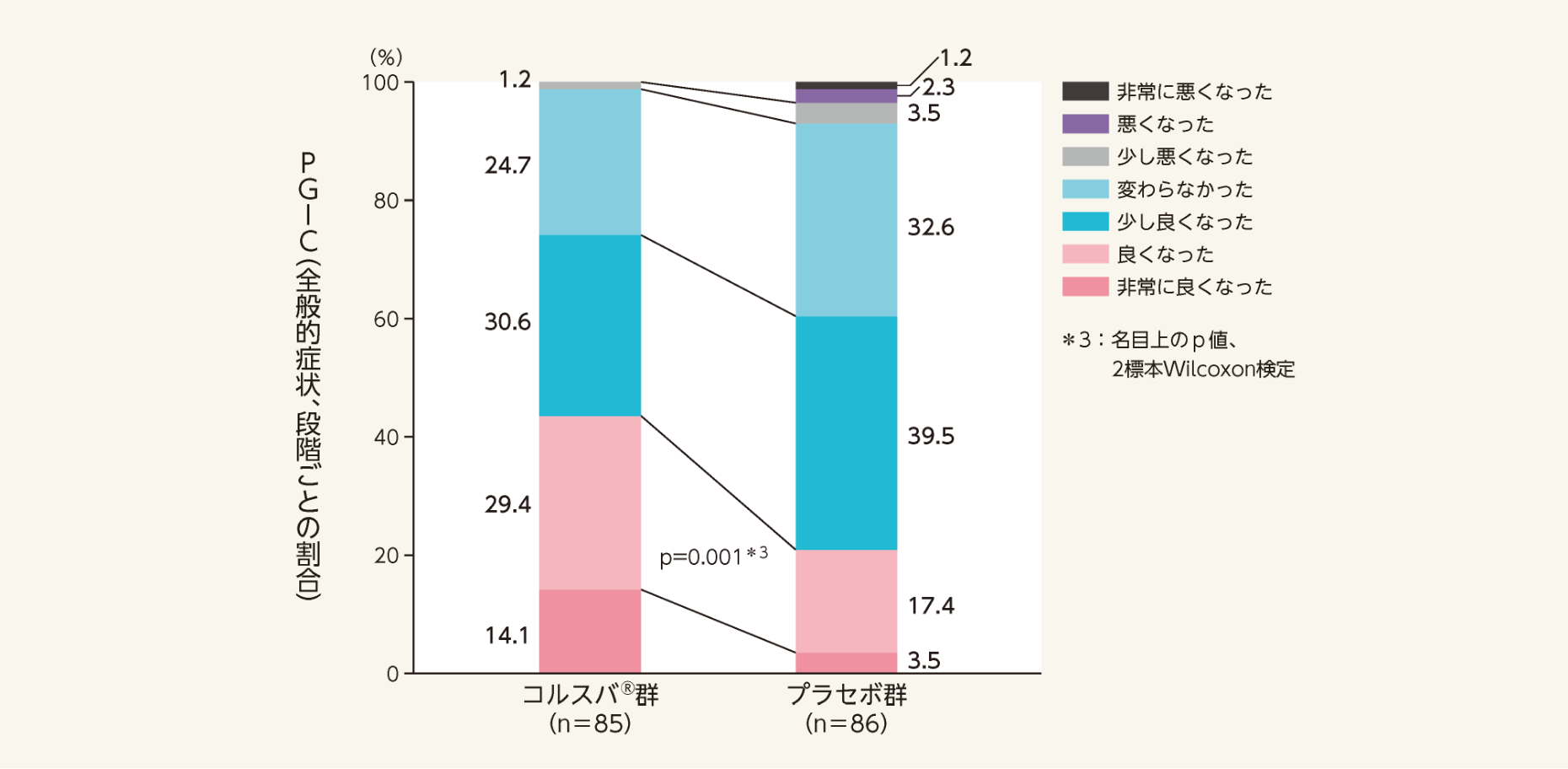
- 患者自身がかゆみの全般的症状を7段階で評価する方法であるPGICを用いて検討した。
安全性
- 本試験における副作用(二重盲検期)
-
二重盲検期における副作用発現率は、コルスバ®群14.6%(13/89例)、プラセボ群3.4%(3/89例)であった。主な副作用は、コルスバ®群で便秘4.5%(4/89例)、血圧低下2.2%(2/89例)、プラセボ群で傾眠、浮動性めまい、筋力低下、血圧低下が各1件(計3例)であった。本試験において死亡に至った副作用及びその他の重篤な副作用は、いずれの投与群でも認められなかった。投与中止に至った副作用は、コルスバ®群3.4%(3/89例)、プラセボ群1.1%(1/89例)であり、その内訳は、コルスバ®群で血圧低下が2例、ほてり、冷汗、腹痛、嘔吐、倦怠感が1例に5件、プラセボ群で浮動性めまい、筋力低下が1例に2件であった。
- 副作用一覧(二重盲検期)
-
例数(%)
SOC
PTコルスバ®群
(n=89)プラセボ群
(n=89)副作用発現例数 13(14.6) 3(3.4) 神経系障害 2(2.2) 2(2.2) 頭痛 1(1.1) 0(0.0) 傾眠 1(1.1) 1(1.1) 浮動性めまい 0(0.0) 1(1.1) 血管障害 1(1.1) 0(0.0) ほてり 1(1.1) 0(0.0) 胃腸障害 7(7.9) 0(0.0) 便秘 4(4.5) 0(0.0) 嘔吐 1(1.1) 0(0.0) 腹部不快感 1(1.1) 0(0.0) 胃食道逆流性疾患 1(1.1) 0(0.0) 腹痛 1(1.1) 0(0.0) 皮膚および皮下組織障害 1(1.1) 0(0.0) 冷汗 1(1.1) 0(0.0) 筋骨格系および結合組織障害 0(0.0) 1(1.1) 筋力低下 0(0.0) 1(1.1) 一般・全身障害および投与部位の状態 2(2.2) 0(0.0) 倦怠感 1(1.1) 0(0.0) 異常感 1(1.1) 0(0.0) 臨床検査 4(4.5) 1(1.1) 血圧低下 2(2.2) 1(1.1) 血中プロラクチン増加 1(1.1) 0(0.0) 血中甲状腺刺激ホルモン減少 1(1.1) 0(0.0) 遊離サイロキシン減少 1(1.1) 0(0.0) MedDRA/J version 23.1





