コルスバ静注透析用シリンジ Q&A
「Q&A」は、医療関係者の皆様に向けて作成しています。
本内容は、製品の適正使用に関する参考情報であり、すべてのケースに当てはまるものではありません。また、国内で承認された効能効果・用法用量の範囲外の情報を含む場合がありますが、当社として推奨するものではありません。製品のご使用にあたっては、最新の電子添文をご確認ください。
「Q&A」のご利用によって、生じた結果につきましては、責任を負いかねますのでご了承ください。
※許可なく複写、複製、転掲、改変等を行うことはご遠慮ください。
-
Q1.コルスバ静注透析用の製品特性を教えてください。
1)コルスバ静注透析用は、KOR(κ(カッパ)オピオイド受容体)に作用する本邦初の静注透析そう痒症改善剤です。 2)第Ⅲ相臨床試験の二重盲検期4週時におけるプラセボ群とコルスバ静注透析用群の平均かゆみNRSスコアのベースラインからの平均変化量の差(両側95%信頼区間)は-0.97(-1.52、-0.42)であり、かゆみ*の改善効果が検証されました(p<0.001、MMRM)。 *:かゆみに対するNRSスコア 3)薬物代謝酵素(CYP)による代謝を受けず(in vitro)、血液透析患者の主要な排泄経路は糞中排泄及び透析による除去でした(外国人データ)。 4)主な副作用として、浮動性めまい、傾眠、便秘、血圧低下などが報告されています。 電子添文の副作用及び臨床成績の安全性の結果をご参照ください。
参考資料:
インタビューフォーム
〔2024年1月作成〕-
Q2.コルスバ静注透析用の効能又は効果を教えてください。
コルスバ静注透析用の効能又は効果は、「血液透析患者におけるそう痒症の改善(既存治療で効果不十分な場合に限る)」です。
参考資料:
電子添文
〔2024年1月作成〕-
Q3.コルスバ静注透析用の用法及び用量を教えてください。
コルスバ静注透析用の用法及び用量は、「通常、成人にはジフェリケファリンとして、下表に示す用量を週3回、透析終了時の返血時に透析回路静脈側に注入する。」です。

参考資料:
電子添文
〔2024年1月作成〕-
Q4.コルスバ静注透析用の投与を忘れた場合、どうすればよいですか?
コルスバ静注透析用の投与を忘れてしまった場合は、次回透析時に投与してください。承認された用法以外の投与(皮下、筋肉内への投与)は、避けてください。
参考資料:
電子添文
〔2024年1月作成〕-
Q5.コルスバ静注透析用の投与患者における自動車の運転等に関する注意事項を教えてください。
眠気、めまい等があらわれることがあるので、コルスバ静注透析用投与中の患者には、自動車の運転等危険を伴う機械の操作には従事させないよう注意してください。
<参考>
自動車運転及び機械操作に対する影響又は精神機能の障害を検討するジフェリケファリンの試験は実施していません。ジフェリケファリンの脳への移行性は低いことが示唆されました(ラット)が、国内血液透析患者対象試験(MR13A9-3、MR13A9-4及びMR13A9-5試験)を統合した結果、ジフェリケファリン0.5μg/kg群で認められた主な副作用は傾眠(2.8%)及び浮動性めまい(2.4%)であったことから、ジフェリケファリン投与中の患者には、自動車の運転等危険を伴う機械の操作には従事させないよう注意喚起が必要と考えられました。参考資料:
電子添文
インタビューフォーム
〔2024年1月作成〕-
Q6.コルスバ静注透析用の肝機能障害患者への投与に関する注意事項を教えてください。
肝機能障害患者に対し、電子添文『9.特定の背景を有する患者に関する注意』の項にて、注意喚起はしていません。
〔2024年1月作成〕
-
Q7.コルスバ静注透析用は妊婦に投与してもよいですか?
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与してください。動物実験(ラット)において、胎盤通過が報告されています。
<参考>
妊娠ラットに1日1回反復静脈内投与したときの妊娠20日における母動物及び胎児血漿中
ジフェリケファリンの非臨床試験では、ラットにおいてジフェリケファリンの胎盤通過性が認められました。妊娠ラットにジフェリケファリンを0.6、2.5及び10mg/kgの用量で、妊娠7日から20日までの期間、1日1回反復静脈内投与したときの妊娠20日における母動物及び胎児血漿中ジフェリケファリン濃度から胎盤通過性を評価した結果、おおむね用量依存的な増加を示し、胎盤を通過することが示唆されました。
臨床試験では、妊婦でのジフェリケファリンの使用に関するデータはありません。
以上より、ラットを用いた非臨床試験で胎盤通過が報告されていることから、妊婦に対しては治療上の有益性が危険性を上回ると判断される場合にのみ投与することが望まれます。
ジフェリケファリン濃度
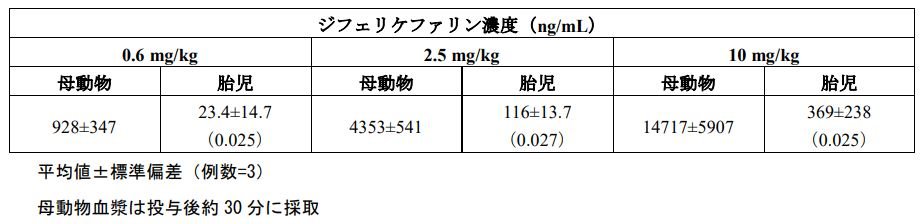
参考資料:
電子添文
新医薬品の「使用上の注意」の解説
〔2024年1月作成〕-
Q8.コルスバ静注透析用は授乳婦に投与してもよいですか?
授乳婦への投与は、中止を検討してください。治療上の有益性と母乳栄養の有益性とを比較検討して、投与による治療を優先すべき場合のみ投与してください。
<参考>
雌性ラットにジフェリケファリンを1日1回反復静脈内投与したときの授乳14日における
ラットを用いた非臨床試験でジフェリケファリンの乳汁中への移行が認められました。
雌性ラットにジフェリケファリンを0.6、2.5及び10mg/kgの用量で、妊娠7日から授乳14日までの期間、1日1回反復静脈内投与したときの授乳14日における母動物血漿、乳汁及び乳児血漿中ジフェリケファリン濃度からジフェリケファリンの乳汁移行を評価した結果、母動物血漿中ジフェリケファリン濃度はおおむね用量依存的な増加を示し、乳汁中への移行が認められました。なお、ラット乳児血漿中への移行は認められませんでした。
以上の結果より、授乳婦に対しては、治療上の有益性と母乳栄養の有益性とを比較検討して、投与による治療を優先すべき場合に投与することが推奨されます。
母動物血漿及び乳汁中、乳児血漿中ジフェリケファリン濃度

参考資料:
電子添文
新医薬品の「使用上の注意」の解説
〔2024年1月作成〕-
Q9.コルスバ静注透析用は小児に投与してもよいですか?
小児等を対象とした臨床試験は実施していないため、小児における安全性及び有効性は確立していません。
参考資料:
電子添文
インタビューフォーム
〔2024年1月作成〕-
Q10.コルスバ静注透析用と併用注意の薬剤を教えてください。
コルスバ静注透析用とオピオイド系薬剤及び(又は)オピオイド拮抗薬との併用により、両剤の作用が増強又は拮抗するおそれがあります。該当の薬剤との併用に注意してください。

参考資料:
電子添文
インタビューフォーム
〔2024年1月作成〕-
Q11.コルスバ静注透析用の副作用を教えてください。
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど医療上適切な処置を行ってください。

コルスバ静注透析用の国内第Ⅲ相臨床試験(二重盲検期、非盲検継続投与期)で認められた副作用は、以下のとおりです。
・二重盲検期
保湿剤、抗ヒスタミン薬、抗アレルギー薬等の既存治療で効果不十分なそう痒症注1)を有する血液透析患者178例を対象に、既存治療に加え、コルスバ静注透析用0.5μg/kgをベースとしたドライウェイトに基づく体重区分ごとの投与量注2)又はプラセボを週3回、透析終了時の返血時に透析回路静脈側から6週間投与しました。
副作用発現割合は、コルスバ静注透析用群14.6%(13/89例)及びプラセボ群3.4%(3/89例)でした。コルスバ静注透析用群における主な副作用は、便秘(4.5%)及び血圧低下(2.2%)でした。
注1)かゆみNumerical Rating Scale(NRS)スコア(0~10)が4.0超、白取の重症度基準に基づくかゆみスコアが3(中等度)以上 注2)45.0kg未満:17.5μg、45.0kg以上65.0kg未満:25.0μg、65.0kg以上85.0kg未満:35.0μg、85.0kg以上:42.5μg・非盲検継続投与期
6週間の二重盲検期を完了した血液透析患者168例を対象に、コルスバ静注透析用0.5μg/kgをベースとしたドライウェイトに基づく体重区分ごとの投与量注3)を週3回、透析終了時の返血時に透析回路静脈側から52週間(二重盲検期開始から58週間)投与しました。
二重盲検期を含む58週間の副作用発現割合は、プラセボ-コルスバ静注透析用群で13.3%(11/83例)、コルスバ静注透析用-コルスバ静注透析用群で18.8%(16/85例)でした。いずれかの投与群で2%以上に認められた副作用は、浮動性めまい(プラセボ-コルスバ静注透析用群2.4%及びコルスバ静注透析用-コルスバ静注透析用群1.2%、以下同順)、傾眠(2.4%及び2.4%)及び便秘(0.0%及び4.7%)でした。
注3)45.0kg未満:17.5μg、45.0kg以上65.0kg未満:25.0μg、65.0kg以上85.0kg未満:35.0μg、85.0kg以上:42.5μg・内分泌系関連事象(甲状腺ホルモン減少、血中甲状腺刺激ホルモン減少、血中プロラクチン増加)、血中カリウム増加に関しては、以下のリンクから、ご参照ください。
■内分泌系関連事象(甲状腺ホルモン減少、血中甲状腺刺激ホルモン減少、血中プロラクチン増加)■
■血中カリウム増加■参考資料:
電子添文
インタビューフォーム
〔2024年1月作成〕-
Q12.コルスバ静注透析用を過量に投与してしまった場合、どのように対処すればよいですか?
コルスバ静注透析用は、血液透析により除去されます。
日本人血液透析患者を対象に、コルスバ静注透析用0.5及び1μg/kg注)を週3回、透析終了時の返血時に透析回路静脈側から1週間投与したとき、透析後の血漿中ジフェリケファリン濃度は透析前の値から76%低下しました。
コルスバ静注透析用の国内第Ⅱ相臨床試験で認められた副作用は、以下のとおりです。
・国内第Ⅱ相臨床試験(MR13A9-3)
既治療のそう痒症を有する血液透析患者を対象に、コルスバ静注透析用0.25、0.5、1.0μg/kg及び1.5μg/kg注)を2週週間投与したときの有効性(上乗せ効果)及び安全性について、無作為化プラセボ対照二重盲検比較により探索的に検討しました。
副作用はプラセボの23.8%(5/21例)、0.25μg/kgの33.3%(7/21例)、0.5μg/kgの61.9%(13/21例)、1.0μg/kgの47.4%(9/19例)、1.5μg/kgの82.6%(19/23例)にみられました。いずれかの投与群で2例以上に発現した副作用は、不眠症、浮動性めまい、頭痛、傾眠、便秘、悪心、異常感、倦怠感、血圧低下、血中プロラクチン増加、血中甲状腺刺激ホルモン減少及び遊離サイロキシン減少でした。・国内後期第Ⅱ相臨床試験(MR13A9-4)
既治療のそう痒症を有する血液透析患者を対象として、コルスバ静注透析用0.25、0.5又は1.0μg/kg注)を8週間投与したときの有効性、安全性及び薬物動態の用量反応関係について、プラセボを対照とした二重盲検法により検討しました。
治療期の副作用の発現率は、プラセボ群11.1%(7/63例)、0.25μg/kg群14.8%(9/61例)、0.5μg/kg群14.8%(9/61例)及び1.0μg/kg群27.4%(17/62例)と用量依存的に増加しました。治療期にいずれかの投与群で3%以上に認められた副作用は、傾眠、浮動性めまい、動悸、嘔吐、悪心、血中甲状腺刺激ホルモン減少でした。注)コルスバ静注透析用の承認されている用量は、「コルスバ静注透析用0.5μg/kgをベースとしたドライウェイトに基づく体重区分ごとの投与量 45.0kg未満:17.5μg、45.0kg以上65.0kg未満:25.0μg、65.0kg以上85.0kg未満:35.0μg、85.0kg以上:42.5μg」です。
参考資料:
電子添文
インタビューフォーム
〔2024年1月作成〕-
Q13.コルスバ静注透析用と他剤を混合して投与(混注)してもよいですか?
他剤との混注は行わないでください。
なお、他剤と連続して投与する際の投与順序に関しては、基準はありません。参考資料:
電子添文
〔2024年1月作成〕-
Q14.コルスバ静注透析用の血中半減期を教えてください。
日本人血液透析患者を対象に、コルスバ静注透析用0.5及び1μg/kg注)を週3回、透析終了時の返血時に透析回路静脈側から1週間投与したときの1回目及び3回目投与における血漿中ジフェリケファリン濃度推移及び薬物動態パラメータは以下のとおりでした。
反復投与時の血漿中ジフェリケファリン濃度推移
血液透析患者における薬物動態パラメータ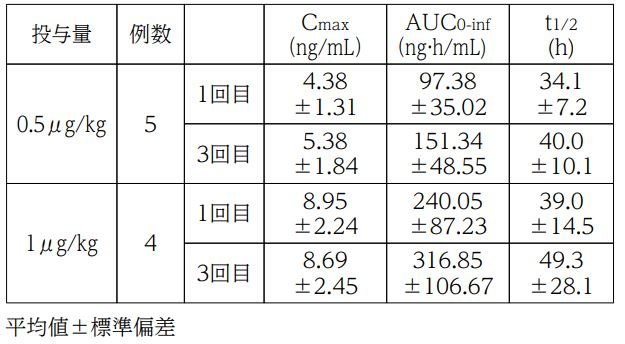
注)コルスバ静注透析用の承認されている用量は、「コルスバ静注透析用0.5μg/kgをベースとしたドライウェイトに基づく体重区分ごとの投与量 45.0kg未満:17.5μg、45.0kg以上65.0kg未満:25.0μg、65.0kg以上85.0kg未満:35.0μg、85.0kg以上:42.5μg」です。
参考資料:
電子添文
〔2024年1月作成〕-
Q15.コルスバ静注透析用の代謝について教えてください。
ジフェリケファリンは、ヒト凍結肝細胞中では代謝されませんでした(in vitro)。
血液透析患者6例に14C-ジフェリケファリン230μg(1.7~3.0μg/kg)注)を単回静脈内投与したとき、血漿中放射能の99%超が未変化体として存在していました。また、尿中及び糞中に認められた代謝物のうち、最も多いものは総放射能の2.44%でした(外国人データ)。注)コルスバ静注透析用の承認されている用量は、「コルスバ静注透析用0.5μg/kgをベースとしたドライウェイトに基づく体重区分ごとの投与量 45.0kg未満:17.5μg、45.0kg以上65.0kg未満:25.0μg、65.0kg以上85.0kg未満:35.0μg、85.0kg以上:42.5μg」です。
ジフェリケファリンは臨床的に重要な代謝酵素CYP*やUGT**の基質、阻害剤又は誘導剤ではなく、これら酵素の基質となる他の薬物との相互作用を引き起こす可能性が低いことが示唆されました(in vitro)。
* 代謝反応を評価したCYP分子種 : CYP1A2、CYP2C8、CYP2C9、CYP2C19、CYP2D6及びCYP3A4 阻害作用を評価したCYP分子種 : CYP1A2、CYP2B6、CYP2C8、CYP2C9、CYP2C19、CYP2D6及びCYP3A 誘導作用を評価したCYP分子種 : CYP1A2、CYP2B6及びCYP3A4 ** 阻害作用を評価したUGT分子種 : UGT1A3、UGT1A9及びUGT2B7 参考資料:
電子添文
インタビューフォーム
〔2024年1月作成〕-
Q16.コルスバ静注透析用の排泄について教えてください。
血液透析患者6例に14C-ジフェリケファリン230μg(1.7~3.0μg/kg)注)を単回静脈内投与したとき、投与した放射能の58.8%が糞中、19.5%が透析液中及び11.2%が尿中に排泄されました(外国人データ)。
注)コルスバ静注透析用の承認されている用量は、「コルスバ静注透析用0.5μg/kgをベースとしたドライウェイトに基づく体重区分ごとの投与量 45.0kg未満:17.5μg、45.0kg以上65.0kg未満:25.0μg、65.0kg以上85.0kg未満:35.0μg、85.0kg以上:42.5μg」です。
参考資料:
電子添文
〔2024年1月作成〕-
Q17.コルスバ静注透析用の作用機序について教えてください。
ジフェリケファリンは、κオピオイド受容体(KOR)選択的な作動薬であり、KORに作用することにより抗そう痒作用を示します。

<参考情報>
作用部位
KORは中枢及び末梢の神経並びに免疫細胞などに発現しており、末梢神経のC線維上のKOR の活性化は、末梢神経の直接的なそう痒シグナルを抑制することが報告されています。低分子合成ペプチドであるジフェリケファリンは脳組織への移行が限定的であったこと (ラット)、ラット慢性膵炎モデル又はラット脊髄神経結紮モデルにおけるジフェリケファリンの鎮痛への影響はKOR阻害薬(nor-BNI)の足蹠皮下投与又は末梢性オピオイド受容体拮抗薬(ナロキソンメチオジド)の腹腔内投与により、それぞれ拮抗されたことから、ジフェリケファリンの作用は主に末梢のKORを介する可能性があります。参考資料:
電子添文
インタビューフォーム
〔2024年1月作成〕-
Q18.コルスバ静注透析用の製剤の安定性を教えてください。
コルスバ静注透析用の安定性は、以下のとおりでした。

参考資料:
インタビューフォーム
〔2024年1月作成〕-
Q19.コルスバ静注透析用の海外での承認・発売状況を教えてください。
ジフェリケファリン酢酸塩は、2021年8月に米国で最初の承認を取得しました。欧州では2022年4月に承認を取得し、2023年8月現在、37の国又は地域で承認されています。
なお、本邦における効能又は効果、用法及び用量は、海外での承認状況とは異なります。コルスバ静注透析用の電子添文に記載されている承認内容の範囲で、コルスバ静注透析用を使用してください。参考資料:
インタビューフォーム
〔2024年1月作成〕





