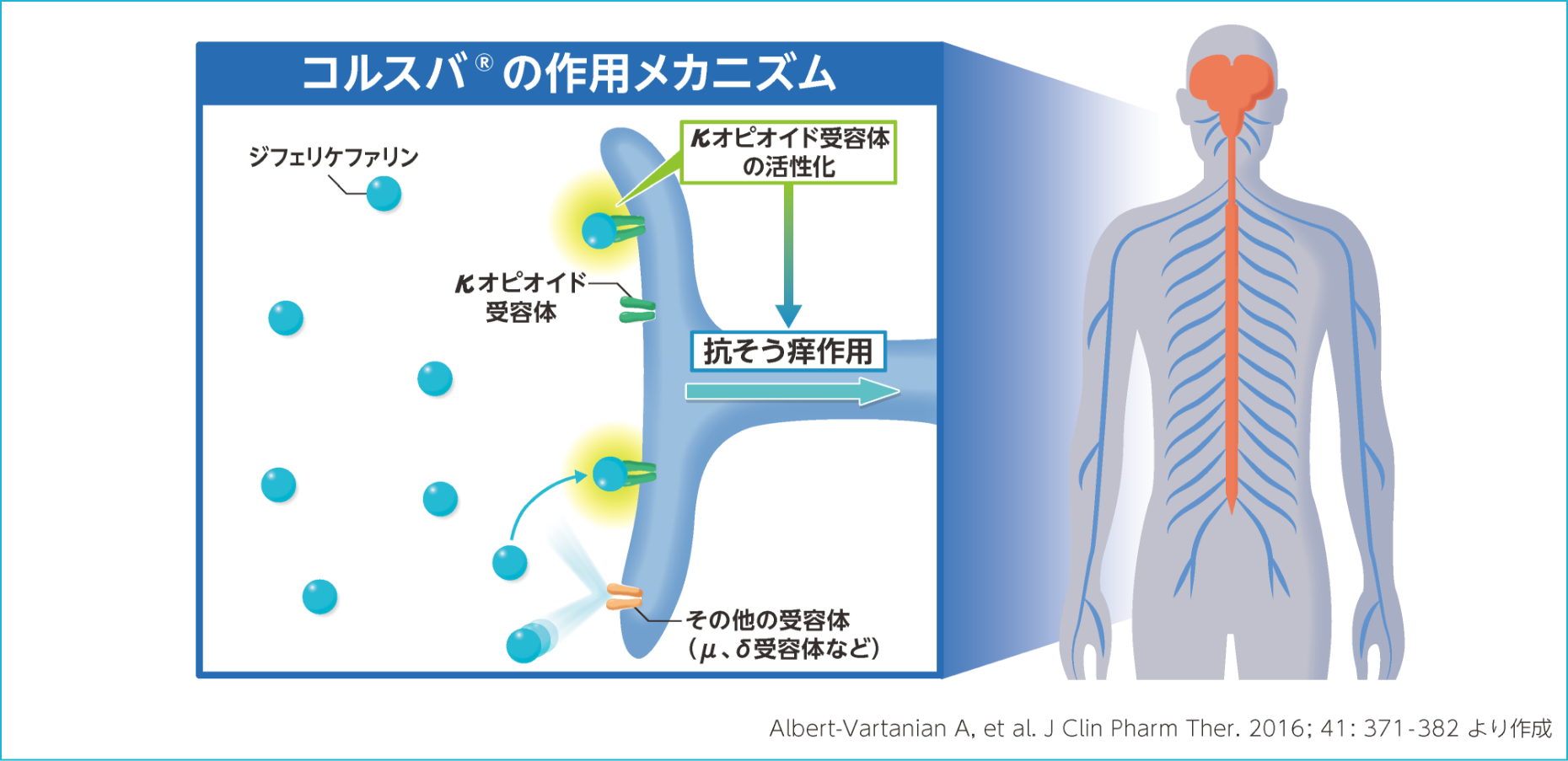
薬効薬理
作用機序
ジフェリケファリンは、κオピオイド受容体(KOR)に選択的に作用することにより、抗そう痒作用を示す。
in vitro試験
(1)ヒトオピオイド受容体選択性(in vitro)1)
ヒトκ、μ及びδオピオイド受容体におけるリガンド結合に対する阻害率(%)は、ジフェリケファリン10 µmol/L の濃度で、それぞれ95、14及び<10であった。
ジフェリケファリンのhKOR、hMOR及びhDORに対する特異的結合
| 受容体 | リガンド結合に対する阻害率(%)(ジフェリケファリン10 µmol/L) | Ki(nmol/L) | |
|---|---|---|---|
| hKOR | 95 | 0.32 | |
| hMOR | 14 | − | |
| hDOR | <10 | − | |
- 方法
- ヒトκオピオイド受容体(hKOR)、μオピオイド受容体(hMOR)及びδオピオイド受容体(hDOR)に対してバインディングアッセイを行い、ジフェリケファリンの受容体選択性について検討した。
(2)オピオイド受容体機能活性(in vitro)2)
mKORに対するジフェリケファリンの%Efficacyは96%、50%作用濃度(EC50)は0.048 nmol/Lであった。 また、hKORに対するジフェリケファリンの%Efficacyは99%、EC50は0.16 nmol/Lであり、hMOR及びhDORに対しては10,000 nmol/Lまで作用活性を示さなかった。
ジフェリケファリンのmKOR、hKOR、hMOR及びhDORに対するアゴニスト作用
| 受容体(アッセイ法) | EC50(nmol/L) | %Efficacy | n |
|---|---|---|---|
| mKOR(cAMP) | 0.048 | 96 | 3 |
| hKOR(RGA) | 0.16 | 99 | 4 |
| hMOR(RGA) | >10,000 | 0 | 1 |
| hDOR(RGA) | >10,000 | 0 | 1 |
- 方法
- マウスκオピオイド受容体(mKOR)の受容体機能活性は、cAMPアッセイを用いて評価した。マウスR1G1細胞を用い、フォルスコリン共存下でジフェリケファリンによるcAMPの産生に及ぼす影響をLANCE™
immuno assay kitを用いて測定した。
ヒトκ、μ及びδオピオイド受容体の受容体機能活性は、各受容体を発現させたHEK293細胞を用いて、ルシフェラーゼレポーター遺伝子アッセイ(Reporter gene assay;RGA)で評価した。対照物質は、KORアゴニストであるFE200666を用いた。cAMPアッセイ及びレポーターアッセイから 得られた値より、EC50(nmol/L)及び最大可能効果に対する割合(percent of maximum possible effect;%MPE)を%Efficacy(%)として算出した。
(3)バインディングキネティクス(in vitro)3)
CHO細胞膜に発現させたhKORと[3H]-ジフェリケファリンを用いたバインディングキネティクス解析の結果から、ジフェリケファリンの結合速度定数(kon)、解離速度定数(koff)、解離定数(Kd)及び半減期(T1/2)はそれぞれ、5.4×107/min・mol/L、0.0075/min、0.14 nmol/L及び92分であった。
- 方法
- バインディングキネティクスは、CHO細胞膜に発現させたhKORに対する1 nmol/L [3H]-ジフェリケファリンの結合量を、シンチレーション近接アッセイ法により定量した。結合率は、1分間あたりの計測数(Count per minute;CPM)を測定することで評価し、解離率は[3H]-ジフェリケファリンと細胞膜を100分間インキュベートした後に、10 µmol/Lのナロキソンを反応させた際のCPMを測定することにより評価した。さらに得られた値より、kon、koff、Kd及びt1/2を算出した。
(4)オピオイド以外の受容体、酵素、イオンチャネル及びトランスポーターへの作用(in vitro)4)
ジフェリケファリンは、10 µmol/Lの濃度では、オピオイド以外の受容体、トランスポーター及びイオンチャネルへのリガンド結合並びに酵素活性に対して30%以上の阻害は示さなかった。
- 方法
- 各種受容体、トランスポーター及びイオンチャネルについてバインディングアッセイを、各種酵素について酵素アッセイを行い、特異的結合に対する阻害を検討した。
(5)ヒト単球由来マクロファージにおけるサイトカイン放出に対する作用(in vitro)5)
ジフェリケファリン処置後、ヒトマクロファージをLPS及びIFNγで刺激した際のIL-1β、IL-6、IL-8、TNFα及びG-CSF濃度は以下のとおりであった。
| サイト カイン |
無処置 | ジフェリケ ファリン (2 nmol/L) |
ジフェリケ ファリン (10 nmol/L) |
ジフェリケ ファリン (50 nmol/L) |
ジフェリケ ファリン (50 nmol/L) + Nor-BNI (10 nmol/L) |
IL-10 (10 ng/mL) |
Nor-BNI (10 nmol/L) |
|
|---|---|---|---|---|---|---|---|---|
| LPS/IFNγ 刺激なし |
LPS/IFNγ 刺激あり |
|||||||
| IL-1β | 1.6 (0.0) |
75.4 (7.6) |
30.8** (2.2) |
45.3** (1.1) |
21.5** (2.4) |
66.7## (2.3) |
2.1¶¶ (1.1) |
39.9 (1.1) |
| IL-6 | 63.8 (1.2) |
677.7 (96.4) |
461.7* (25.5) |
398.0 (108.4) |
563.7 (53.9) |
812.2## (23.7) |
138.6¶ (3.3) |
803.9 (0.6) |
| IL-8 | 255.3 (99.6) |
1457.1 (111.7) |
1045.4* (64.2) |
664.6** (107.8) |
1211.3 (56.7) |
1405.9§∬ (36.1) |
371.7¶¶ (5.8) |
1595.1 (13.3) |
| TNFα | 628.2 (182.6) |
7928.9 (108.0) |
5558.1*** (243.1) |
4044.2*** (350.6) |
6603.4** (235.6) |
9599.9## (128.4) |
3241.4¶¶ (280.6) |
7185.6 (174.8) |
| G-CSF | 730.0 (21.1) |
5230.4 (109.5) |
1304.2*** (296.2) |
2210.6*** (24.9) |
1047.0*** (121.9) |
3881.7## (82.2) |
1032.3¶¶ (21.4) |
1214.3 (29.9) |
*:p<0.05、**:p<0.01、***:p<0.001 vs. LPS/IFNγのみ
♯♯:p<0.001 vs. LPS/ IFNγ + ジフェリケファリン(2 nmol/L, 10 nmol/L及び50 nmol/L)
§:p<0.05 vs. LPS/IFNγ + ジフェリケファリン(50 nmol/L)
∫∫:p<0.01 vs. LPS/ IFNγ + ジフェリケファリン(2 nmol/L又は10 nmol/L)
¶:p<0.005、¶¶:p<0.001 vs. LPS/IFNγのみ
(ANOVA又は両側t検定)
- 方法
- ヒト末梢静脈血(n=1、白色人種、女性)から単球を単離し、顆粒球マクロファージコロニー刺激因子によりマクロファージに分化させた細胞にジフェリケファリン(2、10及び50 nmol/L)又はIL-10(10 ng/mL)を4時間処置後、リポ多糖(LPS、1 µg/mL)及びIFNγ(10 ng/mL)を18時間処置した。培養液中のIL-1β、IL-6、IL-8、TNFα及びG-CSFの濃度は、Luminex 100システムを用いて測定した。
- 1) 社内資料:ヒトオピオイド受容体選択性試験(2023年9月25日承認、CTD2.6.2.2.1.1)
- 2) 社内資料:オピオイド受容体アゴニスト作用(2023年9月25日承認、CTD2.6.2.2.1.2)
- 3) 社内資料:バインディングキネティクス試験(2023年9月25日承認、CTD2.6.2.2.1.3)
- 4) 社内資料:オピオイド以外の受容体、酵素、イオンチャネル及びトランスポーターへの作用(2023年9月25日承認、CTD2.6.2.2.1.4)
- 5) 社内資料:ヒト単球由来マクロファージにおけるサイトカイン放出に対する作用(2023年9月25日承認、CTD2.6.2.2.1.5)
抗そう痒作用
(1)ヒスタミン誘発そう痒モデルに対するジフェリケファリンの抗そう痒作用(マウス)6)
ヒスタミンをマウス頸背部に皮内投与した直後からの30分間の引っ掻き回数は、有意に増加した。ジフェリケファリンの投与により引っ掻き回数は、用量依存的に減少し、0.03~1 mg/kgの用量で有意な減少を示した。ジフェリケファリンの50%有効用量(ED50)は、0.018 mg/kg(95%信頼区間:−0.24、0.17)であった。また、陽性対照であるジフェンヒドラミン塩酸塩も引っ掻き回数が有意に減少した。
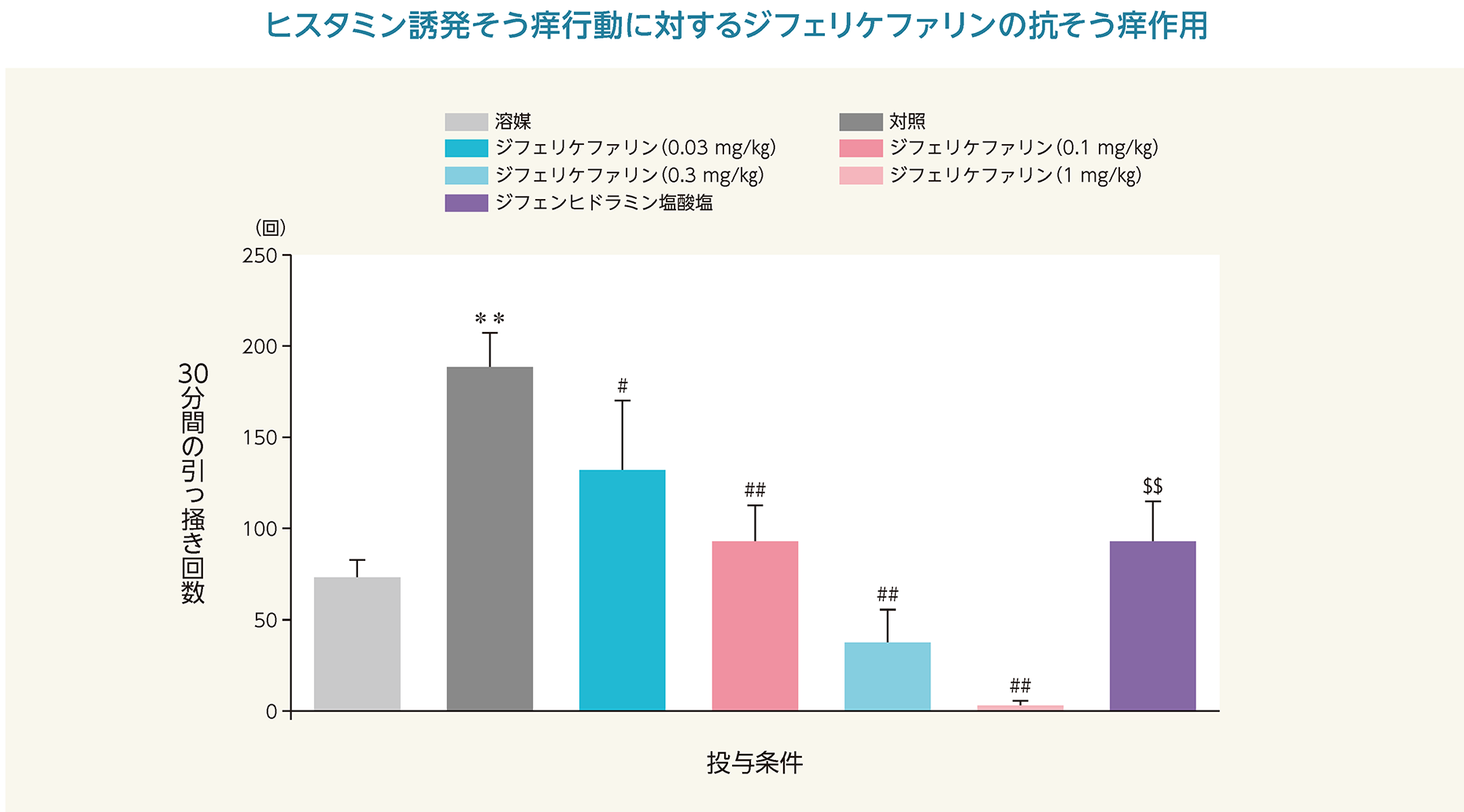
**:p<0.01 vs. 溶媒(Student t検定)
♯:p<0.05、 ♯♯: p<0.01 vs. 対照 (Shirley-Williams検定)
$$:p<0.01 vs. 対照(Student t検定)
- 方法
- 雄性マウス(ICR、6週齢、31~37 g)各10/群を用い、ジフェリケファリン(0.03、0.1、0.3及び1 mg/kg)及び溶媒(生理食塩液)を5mL/kgの容量で静脈内投与、ジフェンヒドラミン塩酸塩(20 mg/kg)を10 mL/kgの容量で腹腔内投与した。ジフェリケファリンではその15分後に、ジフェンヒドラミン塩酸塩ではその30分後にヒスタミン(2 nmol/µL、50µL/site)を頸背部に皮内投与した。その後、30分間、後肢で頸部を引っ掻く行動の回数を測定した。ジフェリケファリン投与による平均引っ掻き回数の相対値を算出し、ED50を算出した。
(2)サブスタンスP誘発そう痒モデルに対するジフェリケファリンの抗そう痒作用(マウス)6)
サブスタンスPをマウス頸背部に皮内投与した直後からの30分間の引っ掻き回数は、有意に増加した。ジフェリケファリンの投与により引っ掻き回数は、0.3~1mg/kgの用量で有意な減少を示した。ジフェリケファリンのED50は、0.32mg/kg(95%信頼区間:0.22、0.44)であった。また、陽性対照であるナルトレキソン塩酸塩も引っ掻き回数が有意に減少した。
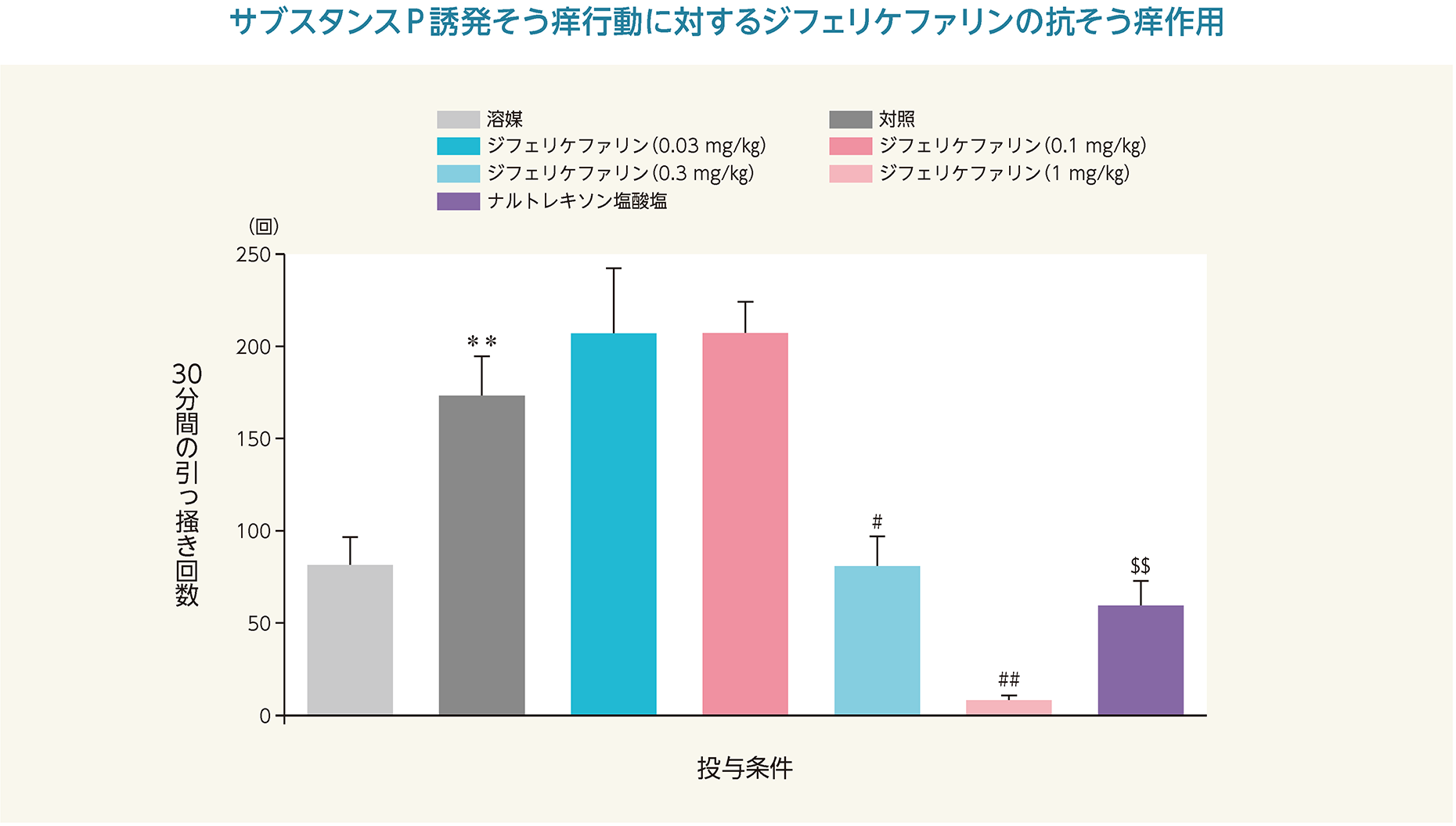
**:p<0.01 vs. 溶媒(Student t検定)
♯:p<0.05、 ♯♯: p<0.01 vs. 対照(Shirley-Williams検定)
$$:p<0.01 vs. 対照(Student t検定)
- 方法
- 雄性マウス(ICR、6週齢、31~38 g)各10/群を用い、ジフェリケファリン(0.03、0.1、0.3及び1 mg/kg)及び溶媒(生理食塩液)を5 mL/kgの容量で静脈内投与、ナルトレキソン塩酸塩(10 mg/kg)を10 mL/kgの容量で皮下投与した。ジフェリケファリンではその15分後に、ナルトレキソン塩酸塩ではその30分後にサブスタンスP(2 nmol/µL、50 µL/site)を頸背部に皮内投与した。その後、30分間、後肢で頸部を引っ掻く行動の回数を測定した。ジフェリケファリン投与による平均引っ掻き回数の相対値を算出し、50%有効用量(ED50)を算出した。
(3)サブスタンスP誘発そう痒モデルにおけるジフェリケファリンの作用持続時間(マウス)6)
生理食塩液の投与後0.5時間にサブスタンスPを投与すると引っ掻き回数は有意に増加した。これに対して、ジフェリケファリンは投与後0.5、6及び12時間において有意に引っ掻き回数を抑制した。
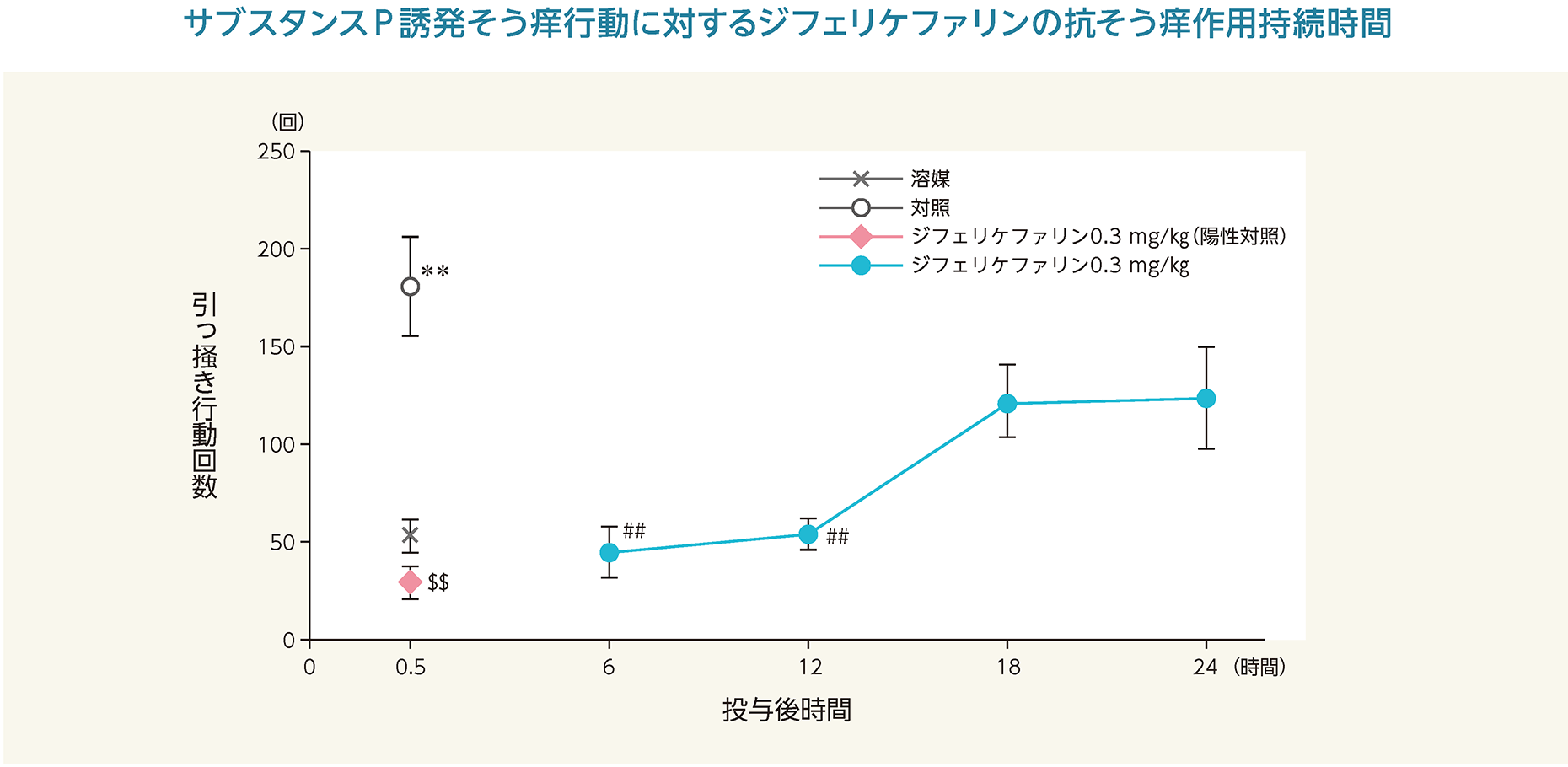
**:p<0.01 vs. 溶媒(Welch's t検定)
$$:p<0.01 vs. 対照(Welch's t検定)
♯♯:p<0.01 vs. 対照(Steel検定)
- 方法
- 雄性マウス(ICR、5週齢、27~33 g)各10/群を用い、ジフェリケファリン(0.3 mg/kg)及び溶媒(生理食塩液)を5 mL/kgの容量で静脈内投与した。ジフェリケファリン0.3 mg/kg投与後0.5時間の群を陽性対照とした。投与後0.5、6、12、18及び24時間にサブスタンスP(5 nmol/µL、50 µL/site)を頸背部に皮内投与し、投与直後から30分間、後肢で頸部を引っ掻く行動の回数を測定した。
- 6)社内資料:抗そう痒作用(2023年9月25日承認、CTD2.6.2.2.2.1)
作用部位(参考情報)
KORは中枢及び末梢の神経並びに免疫細胞などに発現しており7)、末梢神経のC線維上のKORの活性化は、末梢神経の直接的なそう痒シグナルを抑制することが報告されている8)。低分子合成ペプチドであるジフェリケファリンは脳組織への移行が限定的であったこと(ラット)9)、ラット慢性膵炎モデル又はラット脊髄神経結紮モデルにおけるジフェリケファリンの鎮痛への影響はKOR阻害薬(Nor-BNI)の足蹠皮下投与又は末梢性オピオイド受容体拮抗薬(ナロキソンメチオジド)の腹腔内投与により、それぞれ拮抗されたことから、ジフェリケファリンの作用は主に末梢のKORを介する可能性がある10)。
- 7)Snyder LM, et al. Neuron. 2018 ; 99: 1274-1288
- 8)Inan S, et al. Neuroscience. 2009 ; 163: 23-33
- 9)社内資料:組織分布試験(2023年9月25日承認、CTD2.6.4.4.3)
- 10)社内資料:抗侵害作用(2023年9月25日承認、CTD2.6.2.3.1)
鎮痛に及ぼす影響11)(参考情報)
(1)慢性膵炎モデルを用いたジフェリケファリンの鎮痛への影響(ラット)
ジフェリケファリンは、ジブチルスズジクロライド(DBTC)誘発慢性膵炎モデルの腹部痛覚過敏を有意に抑制した。選択的なκオピオイド受容体拮抗薬のノルビナルトルフィミン(Nor-BNI)及び非選択的な末梢性オピオイド受容体拮抗薬のナロキソンメチオジド(NM)はジフェリケファリンの鎮痛への影響に対して拮抗作用を示した。
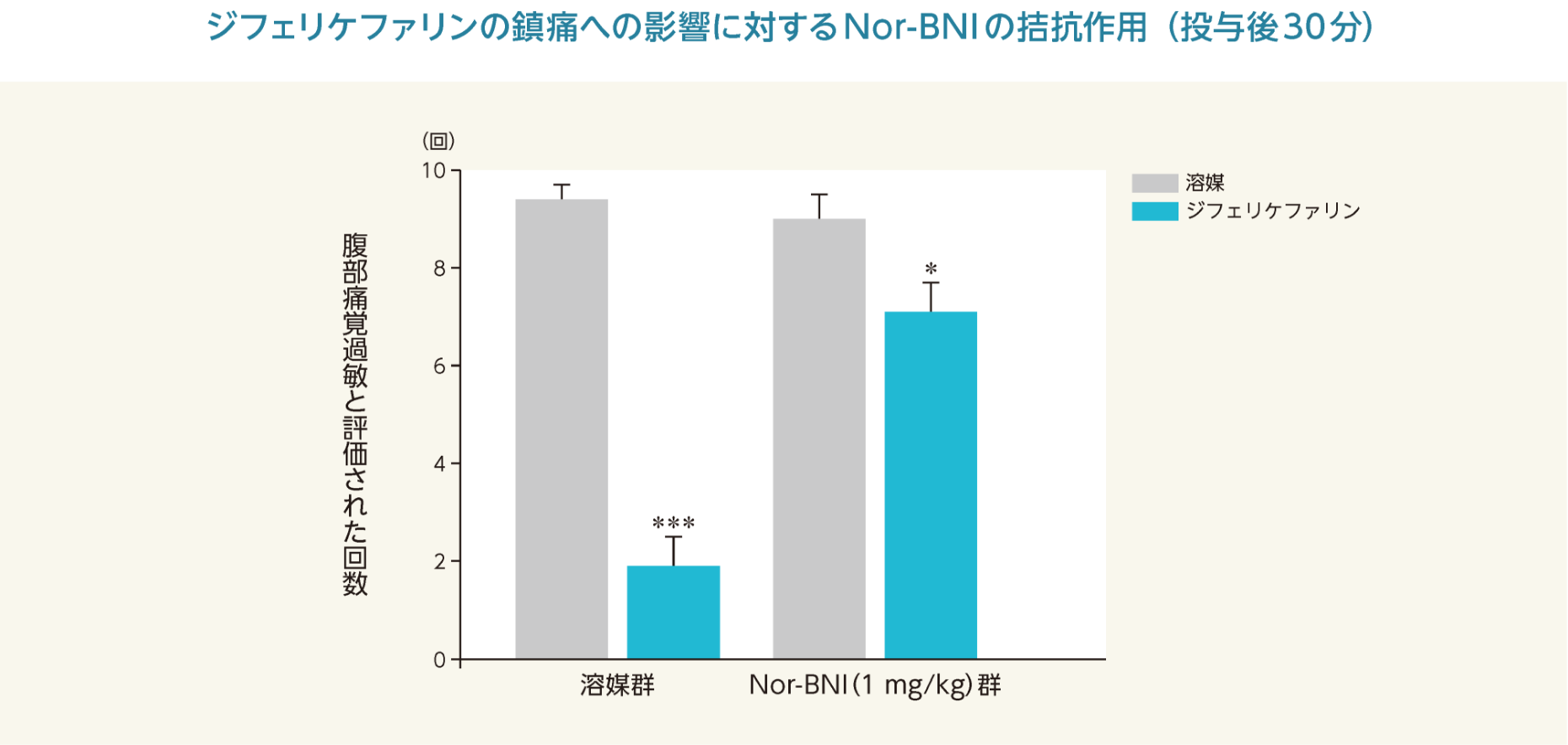
*:p<0.05、***:p<0.001 vs. 溶媒群への溶媒投与(ANOVAの両側検定、Bonferroni法)
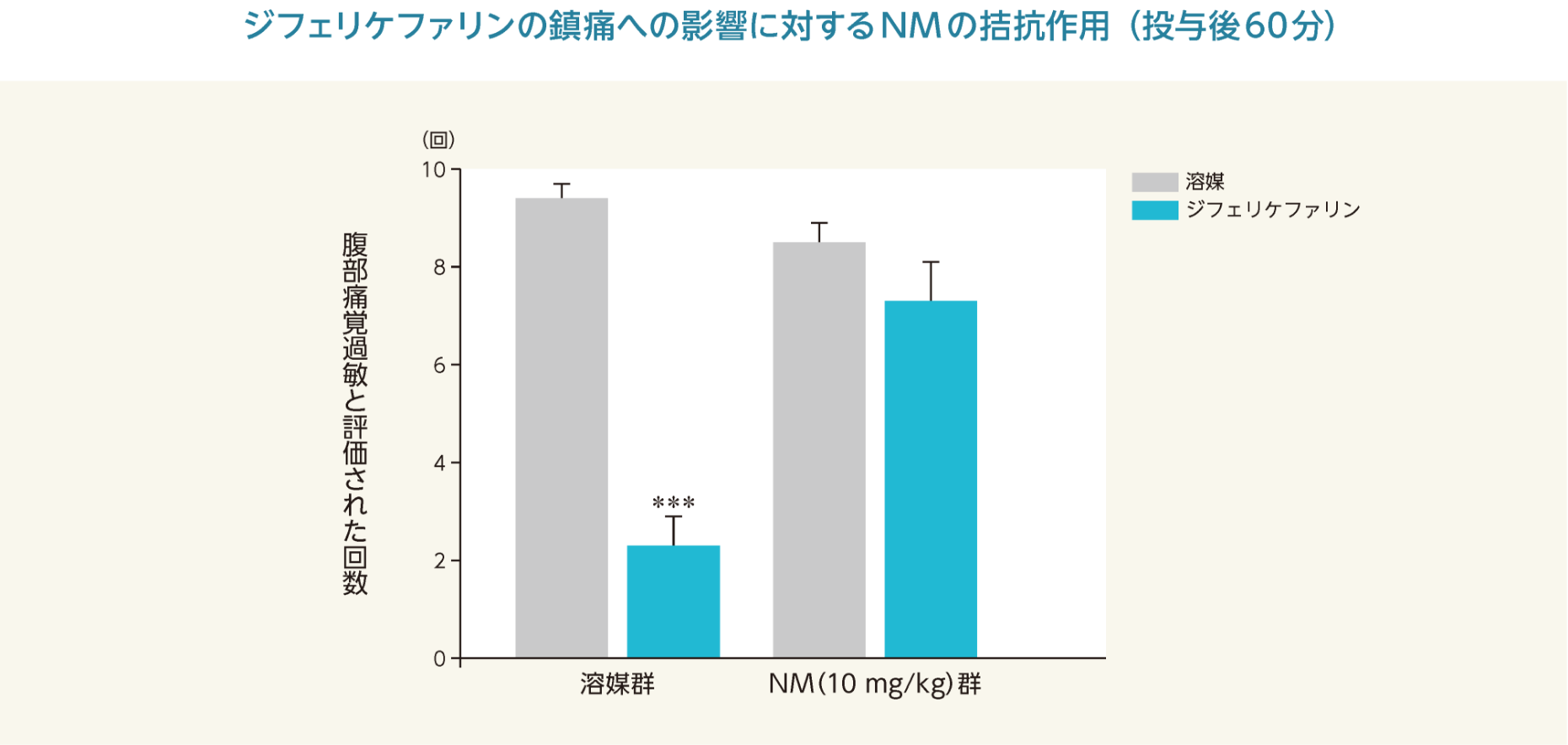
***:p<0.001 vs. 溶媒群への溶媒投与(ANOVAの両側検定、Bonferroni法)
- 方法
- 雄性ラット(SD、体重200~250 g)各6~9/群を用いて慢性膵炎を作製し、ジフェリケファリン(1 mg/kg)及び溶媒(生理食塩液)を1 mL/kgの容量で腹腔内投与した。選択的なκオピオイド受容体拮抗薬のNor-BNI及び非選択的な末梢性オピオイド受容体拮抗薬のNMを生理食塩液に溶解し、ジフェリケファリン又はその溶媒投与30分前にそれぞれ1又は10 mg/kgを1 mL/kgの容量で腹腔内投与した。各薬物投与後、疼痛測定を30分ごとに120分まで行った。膵炎の痛みは、4 gのvon Frey filamentで腹部を刺激(10秒に1回合計10回)し、腹部を激しく引っ込める、腹部を舐める又は全身を引っ込める行動を腹部痛覚過敏として評価した。
(2)神経性疼痛モデルを用いたジフェリケファリンの鎮痛への影響(ラット)
神経性疼痛(脊髄神経結紮;SNL)モデルに溶媒又はノルビナルトルフィミン(Nor-BNI)を足蹠皮下投与した溶媒群の疼痛閾値は、それぞれ2.6±0.5
g又は2.2±0.3
gであったのに対し、溶媒又は(Nor-BNI)を足蹠皮下投与したジフェリケファリン群の疼痛閾値は、それぞれ14±0.7 g又は4.6±0.6 gであった。
疼痛は、ジフェリケファリンにより抑制され、その作用は選択的なκオピオイド受容体拮抗薬であるNor-BNIにより有意(p<0.001 vs.
Vehicle(two-way
ANOVA followed by Bonferroni test)に阻害された。
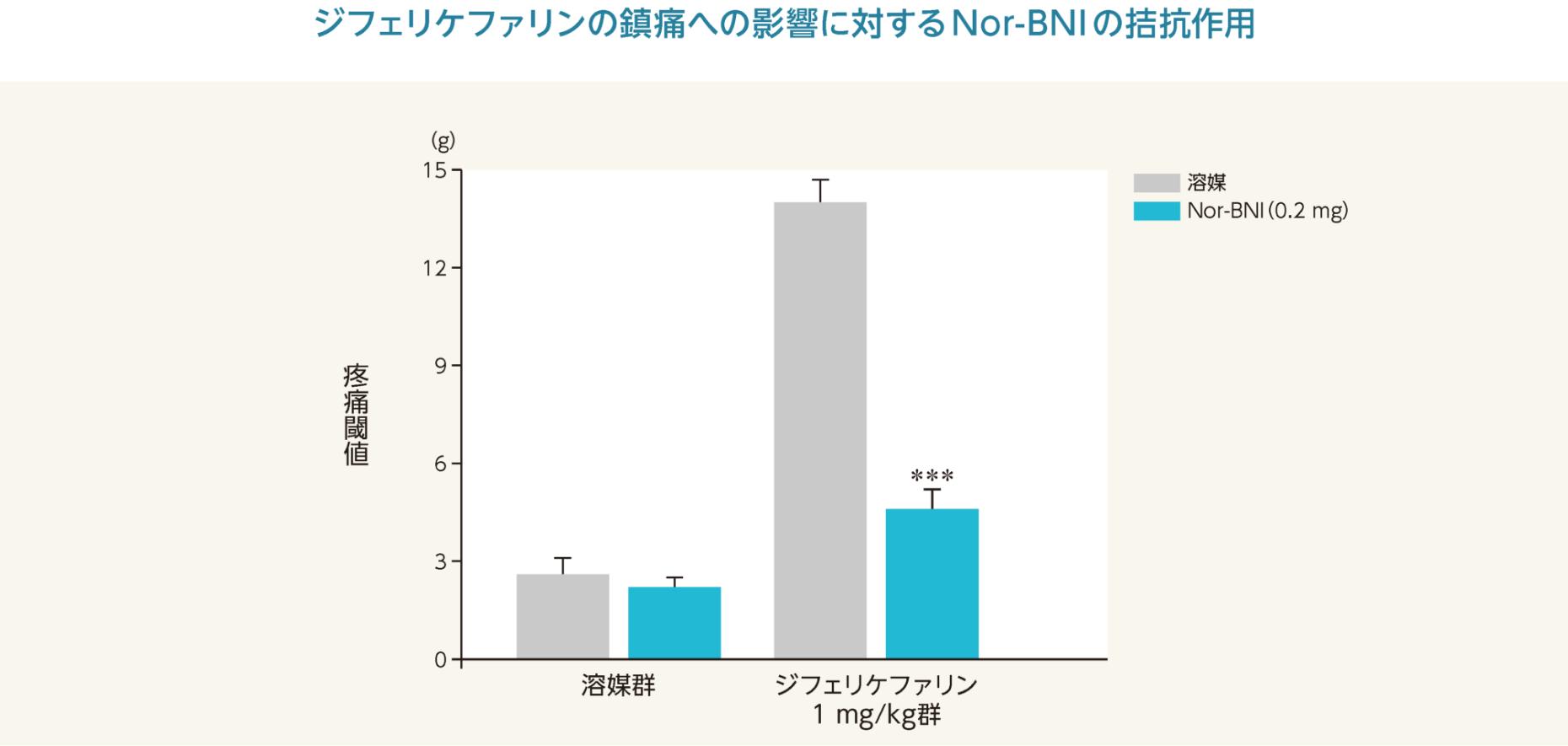
***:p<0.001 vs. 溶媒(ANOVAの両側検定、Bonferroni法)
- 方法
- 雄性ラット(SD、体重250~300 g)各6/群を用いて、SNLモデルを作製し、14日後に実験に用いた。Nor-BNI 0.2 mg又は溶媒(生理食塩液)を足蹠皮下に0.1 mLの容量で投与し、その15分後にジフェリケファリン(1 mg/kg)又は溶媒(生理食塩液)を1 mL/kgの容量で静脈内投与した。モデル作製前、溶媒又はジフェリケファリン投与前及び投与後1時間に疼痛測定を実施した。
- 11) 社内資料:抗侵害作用(2023年9月25日承認、CTD2.6.2.3.1)
- 6. 用法及び用量通常、成人にはジフェリケファリンとして、下表に示す用量を週3回、透析終了時の返血時に透析回路静脈側に注入する。
| ドライウェイト | 投与量 |
|---|---|
| 45 kg未満 | 17.5 µg |
| 45 kg以上65 kg未満 | 25.0 µg |
| 65 kg以上85 kg未満 | 35.0 µg |
| 85 kg以上 | 42.5 µg |





