血液透析患者長期投与試験1,2)
1)承認時評価資料:血液透析患者を対象とした長期投与試験
2)Koiwa F, et al.: J Ren Nutr. 2017; 27: 346-354.(本試験はキッセイ薬品工業株式会社の支援により実施された)
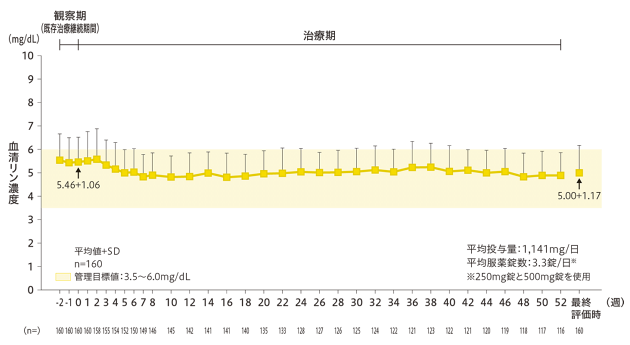
血清リン濃度の推移
血清リン濃度は、0週時5.46±1.06mg/dL、最終評価時5.00±1.17mg/dLであり、52週間管理目標値(CKD-MBDの診療ガイドライン:3.5~6.0mg/dL)の範囲内に維持されました。
【試験概要】
- 目的
- 高リン血症を有する血液透析患者を対象に、ピートルを52週間投与したときの安全性および有効性を検討する。
- 対象
- 高リン血症を有する血液透析中の慢性腎不全患者161例(FAS※:160例)
- 方法
-
2週間の観察期間(既存治療を継続するスクリーニング期間)後、ピートルチュアブル錠を1日3回、食直前に750~3,000mg/日の範囲内で血清リン濃度が3.5~6.0mg/dLに維持されるよう用量調整(開始用量:750mg/日、1回の増減量:750mg/日)を行い、52週間経口投与した。
観察期前に服用している高リン血症治療薬は、観察期終了時まで用量を変更せずに継続投与し、観察期終了時に中止した。
- 試験デザイン
- 非盲検試験
- 有効性評価項目
- 血清リン濃度、補正血清カルシウム濃度、血清intact-PTH濃度など
- 安全性評価項目
- 副作用の発現状況、臨床検査(鉄関連検査・ヘモグロビン)など
- 解析計画
-
有効性について、各評価時期における測定値の要約統計量(例数、平均値、SDなど)を算出した。また、1日平均投与量および服薬錠数を算出した。
安全性について、副作用は治験薬投与以降に発現したものを解析対象とし、発現件数、発現例数および発現率、臨床検査は各評価時期における測定値の要約統計量を求めた。
| ※FAS(Full Analysis Set) : |
最大の解析対象集団。GCP違反例、未投薬例、治療期移行前中止例、不適格例の一部の症例および主要評価項目が得られていない症例を除外した集団。 |
- 7.用法及び用量に関連する注意(抜粋)
- 7.2増量を行う場合は、増量幅を鉄として1日あたりの用量で750mgまでとし、1週間以上の間隔をあけて行うこと。
- 8.重要な基本的注意
- 8.1本剤は、定期的に血清リン、血清カルシウム及び血清PTH濃度を測定しながら投与すること。血清リン、血清カルシウム及び血清PTH濃度の管理目標値及び測定頻度は、学会のガイドライン等、最新の情報を参考にすること。低カルシウム血症の発現あるいは悪化がみられた場合には、活性型ビタミンD製剤やカルシウム製剤の投与を考慮し、カルシウム受容体作動薬が使用されている場合には、カルシウム受容体作動薬の減量等も考慮すること。また、二次性副甲状腺機能亢進症の発現あるいは悪化がみられた場合には、活性型ビタミンD製剤、カルシウム製剤、カルシウム受容体作動薬の投与あるいは他の適切な治療法を考慮すること。
- 8.2本剤は消化管内で作用する薬剤であるが、本剤の成分である鉄が一部吸収されるため、血清フェリチン等を定期的に測定し、鉄過剰に注意すること。また、ヘモグロビン等を定期的に測定し、特に赤血球造血刺激因子製剤と併用する場合には、過剰造血に注意すること。[9.1.2、9.1.3、16.2参照]
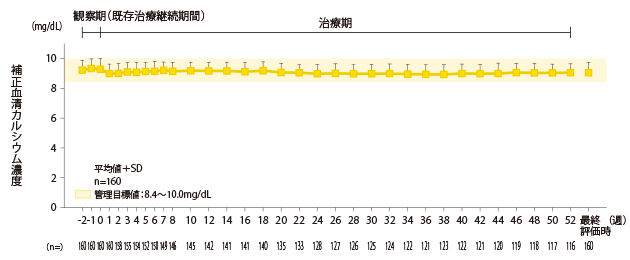
補正血清カルシウム濃度の推移
補正血清カルシウム濃度は、0週時は9.28±0.70mg/dL、最終評価時は9.05±0.70mg/dLと管理目標値(CKD-MBDの診療ガイドライン:8.4~10.0mg/dL)の範囲内でした。
【試験概要】
- 目的
- 高リン血症を有する血液透析患者を対象に、ピートルを52週間投与したときの安全性および有効性を検討する。
- 対象
- 高リン血症を有する血液透析中の慢性腎不全患者161例(FAS※:160例)
- 方法
-
2週間の観察期間(既存治療を継続するスクリーニング期間)後、ピートルチュアブル錠を1日3回、食直前に750~3,000mg/日の範囲内で血清リン濃度が3.5~6.0mg/dLに維持されるよう用量調整(開始用量:750mg/日、1回の増減量:750mg/日)を行い、52週間経口投与した。
観察期前に服用している高リン血症治療薬は、観察期終了時まで用量を変更せずに継続投与し、観察期終了時に中止した。
- 試験デザイン
- 非盲検試験
- 有効性評価項目
- 血清リン濃度、補正血清カルシウム濃度、血清intact-PTH濃度など
- 安全性評価項目
- 副作用の発現状況、臨床検査(鉄関連検査・ヘモグロビン)など
- 解析計画
-
有効性について、各評価時期における測定値の要約統計量(例数、平均値、SDなど)を算出した。また、1日平均投与量および服薬錠数を算出した。
安全性について、副作用は治験薬投与以降に発現したものを解析対象とし、発現件数、発現例数および発現率、臨床検査は各評価時期における測定値の要約統計量を求めた。
| ※FAS(Full Analysis Set) : |
最大の解析対象集団。GCP違反例、未投薬例、治療期移行前中止例、不適格例の一部の症例および主要評価項目が得られていない症例を除外した集団。 |
- 7.用法及び用量に関連する注意(抜粋)
- 7.2増量を行う場合は、増量幅を鉄として1日あたりの用量で750mgまでとし、1週間以上の間隔をあけて行うこと。
- 8.重要な基本的注意
- 8.1本剤は、定期的に血清リン、血清カルシウム及び血清PTH濃度を測定しながら投与すること。血清リン、血清カルシウム及び血清PTH濃度の管理目標値及び測定頻度は、学会のガイドライン等、最新の情報を参考にすること。低カルシウム血症の発現あるいは悪化がみられた場合には、活性型ビタミンD製剤やカルシウム製剤の投与を考慮し、カルシウム受容体作動薬が使用されている場合には、カルシウム受容体作動薬の減量等も考慮すること。また、二次性副甲状腺機能亢進症の発現あるいは悪化がみられた場合には、活性型ビタミンD製剤、カルシウム製剤、カルシウム受容体作動薬の投与あるいは他の適切な治療法を考慮すること。
- 8.2本剤は消化管内で作用する薬剤であるが、本剤の成分である鉄が一部吸収されるため、血清フェリチン等を定期的に測定し、鉄過剰に注意すること。また、ヘモグロビン等を定期的に測定し、特に赤血球造血刺激因子製剤と併用する場合には、過剰造血に注意すること。[9.1.2、9.1.3、16.2参照]
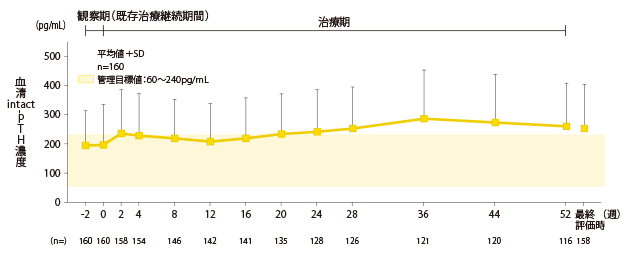
血清intact-PTH濃度の推移
血清intact-PTH濃度は、0週時196.9±138.8pg/mL、最終評価時251.6±151.4pg/mLでした。また、24週から52週にわたって、管理目標値から外れました。
【試験概要】
- 目的
- 高リン血症を有する血液透析患者を対象に、ピートルを52週間投与したときの安全性および有効性を検討する。
- 対象
- 高リン血症を有する血液透析中の慢性腎不全患者161例(FAS※:160例)
- 方法
-
2週間の観察期間(既存治療を継続するスクリーニング期間)後、ピートルチュアブル錠を1日3回、食直前に750~3,000mg/日の範囲内で血清リン濃度が3.5~6.0mg/dLに維持されるよう用量調整(開始用量:750mg/日、1回の増減量:750mg/日)を行い、52週間経口投与した。
観察期前に服用している高リン血症治療薬は、観察期終了時まで用量を変更せずに継続投与し、観察期終了時に中止した。
- 試験デザイン
- 非盲検試験
- 有効性評価項目
- 血清リン濃度、補正血清カルシウム濃度、血清intact-PTH濃度など
- 安全性評価項目
- 副作用の発現状況、臨床検査(鉄関連検査・ヘモグロビン)など
- 解析計画
-
有効性について、各評価時期における測定値の要約統計量(例数、平均値、SDなど)を算出した。また、1日平均投与量および服薬錠数を算出した。
安全性について、副作用は治験薬投与以降に発現したものを解析対象とし、発現件数、発現例数および発現率、臨床検査は各評価時期における測定値の要約統計量を求めた。
| ※FAS(Full Analysis Set) : |
最大の解析対象集団。GCP違反例、未投薬例、治療期移行前中止例、不適格例の一部の症例および主要評価項目が得られていない症例を除外した集団。 |
- 7.用法及び用量に関連する注意(抜粋)
- 7.2増量を行う場合は、増量幅を鉄として1日あたりの用量で750mgまでとし、1週間以上の間隔をあけて行うこと。
- 8.重要な基本的注意
- 8.1本剤は、定期的に血清リン、血清カルシウム及び血清PTH濃度を測定しながら投与すること。血清リン、血清カルシウム及び血清PTH濃度の管理目標値及び測定頻度は、学会のガイドライン等、最新の情報を参考にすること。低カルシウム血症の発現あるいは悪化がみられた場合には、活性型ビタミンD製剤やカルシウム製剤の投与を考慮し、カルシウム受容体作動薬が使用されている場合には、カルシウム受容体作動薬の減量等も考慮すること。また、二次性副甲状腺機能亢進症の発現あるいは悪化がみられた場合には、活性型ビタミンD製剤、カルシウム製剤、カルシウム受容体作動薬の投与あるいは他の適切な治療法を考慮すること。
- 8.2本剤は消化管内で作用する薬剤であるが、本剤の成分である鉄が一部吸収されるため、血清フェリチン等を定期的に測定し、鉄過剰に注意すること。また、ヘモグロビン等を定期的に測定し、特に赤血球造血刺激因子製剤と併用する場合には、過剰造血に注意すること。[9.1.2、9.1.3、16.2参照]
安全性:副作用
副作用発現率は32.3%(52/161例)であり、主な副作用は、下痢22.4%(36例)および便秘2.5%(4例)でした。
なお、重篤な副作用としてイレウスが1例に認められました。投与中止に至った副作用として、下痢が6例、痒疹が1例、腹部不快感が1例、胃腸の炎症が1例、悪心が1例、血清フェリチン増加が1例、アラニンアミノトランスフェラーゼ増加が1例に認められました。
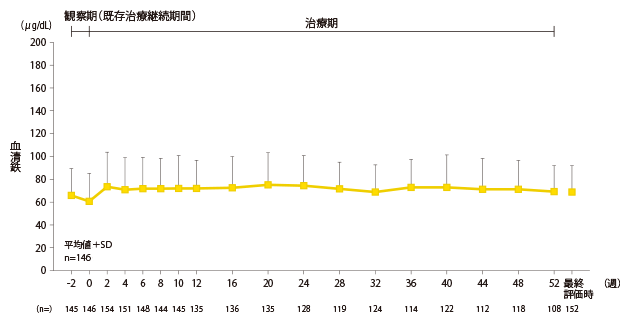
安全性:鉄・貧血関連検査値の推移
血清鉄の推移
【試験概要】
- 目的
- 高リン血症を有する血液透析患者を対象に、ピートルを52週間投与したときの安全性および有効性を検討する。
- 対象
- 高リン血症を有する血液透析中の慢性腎不全患者161例(FAS※:160例)
- 方法
-
2週間の観察期間(既存治療を継続するスクリーニング期間)後、ピートルチュアブル錠を1日3回、食直前に750~3,000mg/日の範囲内で血清リン濃度が3.5~6.0mg/dLに維持されるよう用量調整(用量:750mg/日、1回の増減量:750mg/日)を行い、52週間経口投与した。
観察期前に服用している高リン血症治療薬は、観察期終了時まで用量を変更せずに継続投与し、観察期終了時に中止した。
- 試験デザイン
- 非盲検試験
- 有効性評価項目
- 血清リン濃度、補正血清カルシウム濃度、血清intact-PTH濃度など
- 安全性評価項目
- 副作用の発現状況、臨床検査(鉄関連検査・ヘモグロビン)など
- 解析計画
-
有効性について、各評価時期における測定値の要約統計量(例数、平均値、SDなど)を算出した。また、1日平均投与量および服薬錠数を算出した。
安全性について、副作用は治験薬投与以降に発現したものを解析対象とし、発現件数、発現例数および発現率、臨床検査は各評価時期における測定値の要約統計量を求めた。
| ※FAS(Full Analysis Set) : |
最大の解析対象集団。GCP違反例、未投薬例、治療期移行前中止例、不適格例の一部の症例および主要評価項目が得られていない症例を除外した集団。 |
- 7.用法及び用量に関連する注意(抜粋)
- 7.2増量を行う場合は、増量幅を鉄として1日あたりの用量で750mgまでとし、1週間以上の間隔をあけて行うこと。
- 8.重要な基本的注意
- 8.1本剤は、定期的に血清リン、血清カルシウム及び血清PTH濃度を測定しながら投与すること。血清リン、血清カルシウム及び血清PTH濃度の管理目標値及び測定頻度は、学会のガイドライン等、最新の情報を参考にすること。低カルシウム血症の発現あるいは悪化がみられた場合には、活性型ビタミンD製剤やカルシウム製剤の投与を考慮し、カルシウム受容体作動薬が使用されている場合には、カルシウム受容体作動薬の減量等も考慮すること。また、二次性副甲状腺機能亢進症の発現あるいは悪化がみられた場合には、活性型ビタミンD製剤、カルシウム製剤、カルシウム受容体作動薬の投与あるいは他の適切な治療法を考慮すること。
- 8.2本剤は消化管内で作用する薬剤であるが、本剤の成分である鉄が一部吸収されるため、血清フェリチン等を定期的に測定し、鉄過剰に注意すること。また、ヘモグロビン等を定期的に測定し、特に赤血球造血刺激因子製剤と併用する場合には、過剰造血に注意すること。[9.1.2、9.1.3、16.2参照]
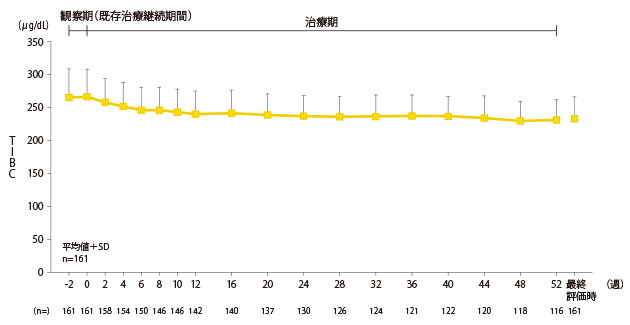
安全性:鉄・貧血関連検査値の推移
TIBCの推移
|
TIBC(total iron binding capacity) : |
総鉄結合能。鉄結合蛋白であるトランスフェリンに結合しうる鉄量のこと。一方、未結合のトランスフェリンと結合できる鉄の総量を不飽和鉄結合能(UIBC:unsaturated iron binding capacity)といい、"TIBC=血清鉄+UIBC"で表される。健常人の場合、トランスフェリンのおよそ1/3が鉄と結合している。 |
【試験概要】
- 目的
- 高リン血症を有する血液透析患者を対象に、ピートルを52週間投与したときの安全性および有効性を検討する。
- 対象
- 高リン血症を有する血液透析中の慢性腎不全患者161例(FAS※:160例)
- 方法
-
2週間の観察期間(既存治療を継続するスクリーニング期間)後、ピートルチュアブル錠を1日3回、食直前に750~3,000mg/日の範囲内で血清リン濃度が3.5~6.0mg/dLに維持されるよう用量調整(開始用量:750mg/日、1回の増減量:750mg/日)を行い、52週間経口投与した。
観察期前に服用している高リン血症治療薬は、観察期終了時まで用量を変更せずに継続投与し、観察期終了時に中止した。
- 試験デザイン
- 非盲検試験
- 有効性評価項目
- 血清リン濃度、補正血清カルシウム濃度、血清intact-PTH濃度など
- 安全性評価項目
- 副作用の発現状況、臨床検査(鉄関連検査・ヘモグロビン)など
- 解析計画
-
有効性について、各評価時期における測定値の要約統計量(例数、平均値、SDなど)を算出した。また、1日平均投与量および服薬錠数を算出した。
安全性について、副作用は治験薬投与以降に発現したものを解析対象とし、発現件数、発現例数および発現率、臨床検査は各評価時期における測定値の要約統計量を求めた。
| ※FAS(Full Analysis Set) : |
最大の解析対象集団。GCP違反例、未投薬例、治療期移行前中止例、不適格例の一部の症例および主要評価項目が得られていない症例を除外した集団。 |
- 7.用法及び用量に関連する注意(抜粋)
- 7.2増量を行う場合は、増量幅を鉄として1日あたりの用量で750mgまでとし、1週間以上の間隔をあけて行うこと。
- 8.重要な基本的注意
- 8.1本剤は、定期的に血清リン、血清カルシウム及び血清PTH濃度を測定しながら投与すること。血清リン、血清カルシウム及び血清PTH濃度の管理目標値及び測定頻度は、学会のガイドライン等、最新の情報を参考にすること。低カルシウム血症の発現あるいは悪化がみられた場合には、活性型ビタミンD製剤やカルシウム製剤の投与を考慮し、カルシウム受容体作動薬が使用されている場合には、カルシウム受容体作動薬の減量等も考慮すること。また、二次性副甲状腺機能亢進症の発現あるいは悪化がみられた場合には、活性型ビタミンD製剤、カルシウム製剤、カルシウム受容体作動薬の投与あるいは他の適切な治療法を考慮すること。
- 8.2本剤は消化管内で作用する薬剤であるが、本剤の成分である鉄が一部吸収されるため、血清フェリチン等を定期的に測定し、鉄過剰に注意すること。また、ヘモグロビン等を定期的に測定し、特に赤血球造血刺激因子製剤と併用する場合には、過剰造血に注意すること。[9.1.2、9.1.3、16.2参照]
安全性:鉄・貧血関連検査値の推移
TSATの推移
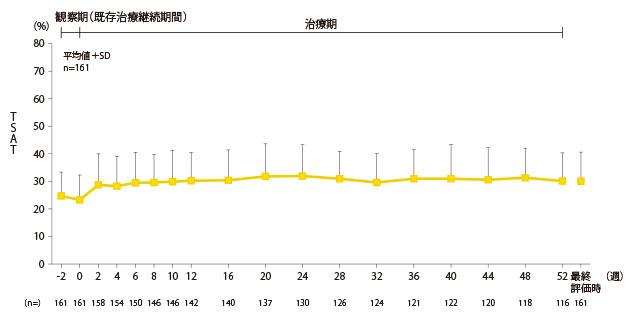
| TSAT(transferrin saturation) : |
トランスフェリン飽和度。鉄と結合したトランスフェリンの割合。 |
【試験概要】
- 目的
- 高リン血症を有する血液透析患者を対象に、ピートルを52週間投与したときの安全性および有効性を検討する。
- 対象
- 高リン血症を有する血液透析中の慢性腎不全患者161例(FAS※:160例)
- 方法
-
2週間の観察期間(既存治療を継続するスクリーニング期間)後、ピートルチュアブル錠を1日3回、食直前に750~3,000mg/日の範囲内で血清リン濃度が3.5~6.0mg/dLに維持されるよう用量調整(開始用量:750mg/日、1回の増減量:750mg/日)を行い、52週間経口投与した。
観察期前に服用している高リン血症治療薬は、観察期終了時まで用量を変更せずに継続投与し、観察期終了時に中止した。
- 試験デザイン
- 非盲検試験
- 有効性評価項目
- 血清リン濃度、補正血清カルシウム濃度、血清intact-PTH濃度など
- 安全性評価項目
- 副作用の発現状況、臨床検査(鉄関連検査・ヘモグロビン)など
- 解析計画
-
有効性について、各評価時期における測定値の要約統計量(例数、平均値、SDなど)を算出した。また、1日平均投与量および服薬錠数を算出した。
安全性について、副作用は治験薬投与以降に発現したものを解析対象とし、発現件数、発現例数および発現率、臨床検査は各評価時期における測定値の要約統計量を求めた。
| ※FAS(Full Analysis Set) : |
最大の解析対象集団。GCP違反例、未投薬例、治療期移行前中止例、不適格例の一部の症例および主要評価項目が得られていない症例を除外した集団。 |
- 7.用法及び用量に関連する注意(抜粋)
- 7.2増量を行う場合は、増量幅を鉄として1日あたりの用量で750mgまでとし、1週間以上の間隔をあけて行うこと。
- 8.重要な基本的注意
- 8.1本剤は、定期的に血清リン、血清カルシウム及び血清PTH濃度を測定しながら投与すること。血清リン、血清カルシウム及び血清PTH濃度の管理目標値及び測定頻度は、学会のガイドライン等、最新の情報を参考にすること。低カルシウム血症の発現あるいは悪化がみられた場合には、活性型ビタミンD製剤やカルシウム製剤の投与を考慮し、カルシウム受容体作動薬が使用されている場合には、カルシウム受容体作動薬の減量等も考慮すること。また、二次性副甲状腺機能亢進症の発現あるいは悪化がみられた場合には、活性型ビタミンD製剤、カルシウム製剤、カルシウム受容体作動薬の投与あるいは他の適切な治療法を考慮すること。
- 8.2本剤は消化管内で作用する薬剤であるが、本剤の成分である鉄が一部吸収されるため、血清フェリチン等を定期的に測定し、鉄過剰に注意すること。また、ヘモグロビン等を定期的に測定し、特に赤血球造血刺激因子製剤と併用する場合には、過剰造血に注意すること。[9.1.2、9.1.3、16.2参照]
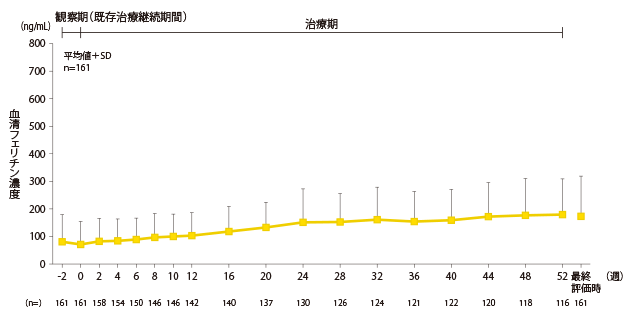
安全性:鉄・貧血関連検査値の推移
血清フェリチン濃度の推移
【試験概要】
- 目的
- 高リン血症を有する血液透析患者を対象に、ピートルを52週間投与したときの安全性および有効性を検討する。
- 対象
- 高リン血症を有する血液透析中の慢性腎不全患者161例(FAS※:160例)
- 方法
-
2週間の観察期間(既存治療を継続するスクリーニング期間)後、ピートルチュアブル錠を1日3回、食直前に750~3,000mg/日の範囲内で血清リン濃度が3.5~6.0mg/dLに維持されるよう用量調整(開始用量:750mg/日、1回の増減量:750mg/日)を行い、52週間経口投与した。
観察期前に服用している高リン血症治療薬は、観察期終了時まで用量を変更せずに継続投与し、観察期終了時に中止した。
- 試験デザイン
- 非盲検試験
- 有効性評価項目
- 血清リン濃度、補正血清カルシウム濃度、血清intact-PTH濃度など
- 安全性評価項目
- 副作用の発現状況、臨床検査(鉄関連検査・ヘモグロビン)など
- 解析計画
-
有効性について、各評価時期における測定値の要約統計量(例数、平均値、SDなど)を算出した。また、1日平均投与量および服薬錠数を算出した。
安全性について、副作用は治験薬投与以降に発現したものを解析対象とし、発現件数、発現例数および発現率、臨床検査は各評価時期における測定値の要約統計量を求めた。
| ※FAS(Full Analysis Set) : |
最大の解析対象集団。GCP違反例、未投薬例、治療期移行前中止例、不適格例の一部の症例および主要評価項目が得られていない症例を除外した集団。 |
- 7.用法及び用量に関連する注意(抜粋)
- 7.2増量を行う場合は、増量幅を鉄として1日あたりの用量で750mgまでとし、1週間以上の間隔をあけて行うこと。
- 8.重要な基本的注意
- 8.1本剤は、定期的に血清リン、血清カルシウム及び血清PTH濃度を測定しながら投与すること。血清リン、血清カルシウム及び血清PTH濃度の管理目標値及び測定頻度は、学会のガイドライン等、最新の情報を参考にすること。低カルシウム血症の発現あるいは悪化がみられた場合には、活性型ビタミンD製剤やカルシウム製剤の投与を考慮し、カルシウム受容体作動薬が使用されている場合には、カルシウム受容体作動薬の減量等も考慮すること。また、二次性副甲状腺機能亢進症の発現あるいは悪化がみられた場合には、活性型ビタミンD製剤、カルシウム製剤、カルシウム受容体作動薬の投与あるいは他の適切な治療法を考慮すること。
- 8.2本剤は消化管内で作用する薬剤であるが、本剤の成分である鉄が一部吸収されるため、血清フェリチン等を定期的に測定し、鉄過剰に注意すること。また、ヘモグロビン等を定期的に測定し、特に赤血球造血刺激因子製剤と併用する場合には、過剰造血に注意すること。[9.1.2、9.1.3、16.2参照]
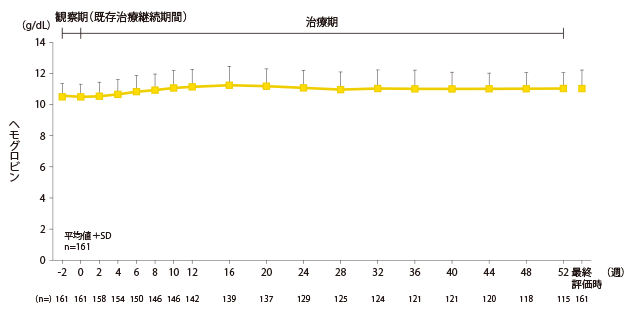
安全性:鉄・貧血関連検査値の推移
ヘモグロビンの推移
【試験概要】
- 目的
- 高リン血症を有する血液透析患者を対象に、ピートルを52週間投与したときの安全性および有効性を検討する。
- 対象
- 高リン血症を有する血液透析中の慢性腎不全患者161例(FAS※:160例)
- 方法
-
2週間の観察期間(既存治療を継続するスクリーニング期間)後、ピートルチュアブル錠を1日3回、食直前に750~3,000mg/日の範囲内で血清リン濃度が3.5~6.0mg/dLに維持されるよう用量調整(開始用量:750mg/日、1回の増減量:750mg/日)を行い、52週間経口投与した。
観察期前に服用している高リン血症治療薬は、観察期終了時まで用量を変更せずに継続投与し、観察期終了時に中止した。
- 試験デザイン
- 非盲検試験
- 有効性評価項目
- 血清リン濃度、補正血清カルシウム濃度、血清intact-PTH濃度など
- 安全性評価項目
- 副作用の発現状況、臨床検査(鉄関連検査・ヘモグロビン)など
- 解析計画
-
有効性について、各評価時期における測定値の要約統計量(例数、平均値、SDなど)を算出した。また、1日平均投与量および服薬錠数を算出した。
安全性について、副作用は治験薬投与以降に発現したものを解析対象とし、発現件数、発現例数および発現率、臨床検査は各評価時期における測定値の要約統計量を求めた。
| ※FAS(Full Analysis Set) : |
最大の解析対象集団。GCP違反例、未投薬例、治療期移行前中止例、不適格例の一部の症例および主要評価項目が得られていない症例を除外した集団。 |
- 7.用法及び用量に関連する注意(抜粋)
- 7.2増量を行う場合は、増量幅を鉄として1日あたりの用量で750mgまでとし、1週間以上の間隔をあけて行うこと。
- 8.重要な基本的注意
- 8.1本剤は、定期的に血清リン、血清カルシウム及び血清PTH濃度を測定しながら投与すること。血清リン、血清カルシウム及び血清PTH濃度の管理目標値及び測定頻度は、学会のガイドライン等、最新の情報を参考にすること。低カルシウム血症の発現あるいは悪化がみられた場合には、活性型ビタミンD製剤やカルシウム製剤の投与を考慮し、カルシウム受容体作動薬が使用されている場合には、カルシウム受容体作動薬の減量等も考慮すること。また、二次性副甲状腺機能亢進症の発現あるいは悪化がみられた場合には、活性型ビタミンD製剤、カルシウム製剤、カルシウム受容体作動薬の投与あるいは他の適切な治療法を考慮すること。
- 8.2本剤は消化管内で作用する薬剤であるが、本剤の成分である鉄が一部吸収されるため、血清フェリチン等を定期的に測定し、鉄過剰に注意すること。また、ヘモグロビン等を定期的に測定し、特に赤血球造血刺激因子製剤と併用する場合には、過剰造血に注意すること。[9.1.2、9.1.3、16.2参照]