Jayne DRW et al.:N Eng J Med 384:599, 2021
COI:ChemoCentryx実施治験
試験概要
目的
活動性のANCA関連血管炎患者[顕微鏡的多発血管炎(MPA)及び多発血管炎性肉芽腫症(GPA)患者]を対象に、シクロホスファミド及びアザチオプリンの順次投与と併用した場合、又はリツキシマブと併用した場合における、プレドニゾン注)に対するタブネオスの寛解導入及び寛解維持における非劣性及び優越性を検証する。
対象
活動性のMPA及びGPA患者331例(日本人21例を含む)
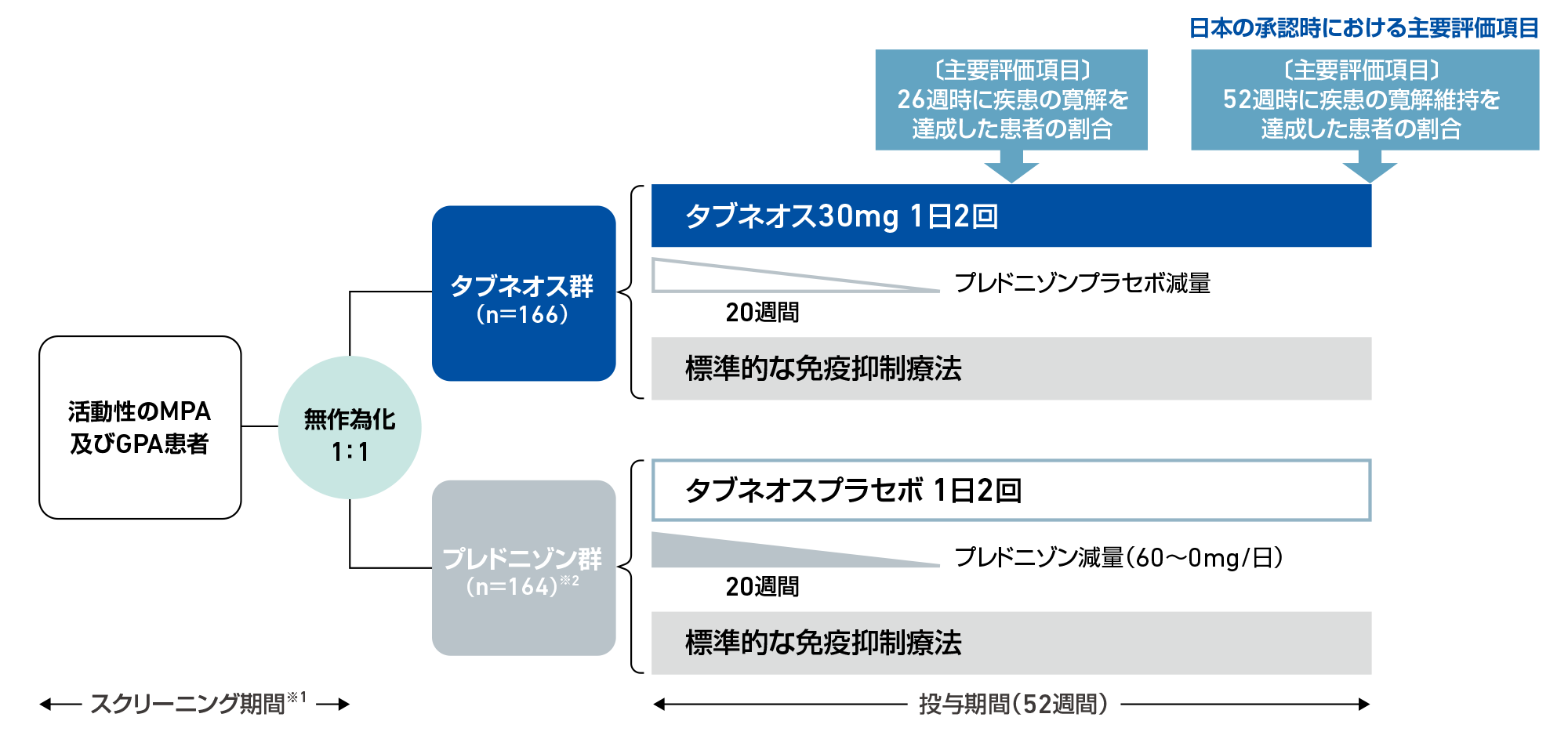
試験デザイン
多施設共同、無作為化、二重盲検、ダブルダミー、実薬対照試験
方法
対象患者を1:1で無作為にタブネオス群又はプレドニゾン群の2群に割り付けた。タブネオス群(166例)はタブネオス1回30mgを1日2回で52週間投与し、プレドニゾンプラセボを20週間投与した。プレドニゾン群(165例)はタブネオスプラセボを52週間投与し、プレドニゾンを20週間かけて60mg/日から0になるよう漸減投与した。なお、すべての患者は標準的な免疫抑制療法[静注リツキシマブ375mg/m2を週1回4週間又は、静注シクロホスファミドを投与開始時、2、4、7、10及び13週時に15mg/kg(最大1.2gまで)又は、経口シクロホスファミド2mg/kg/日を14週間]のいずれかが投与された。シクロホスファミドを投与された患者は、15週時から試験終了時までアザチオプリン最大2mg/kg/日、忍容性に問題があった場合にミコフェノール酸モフェチル注)最大2g/日又はミコフェノール酸ナトリウム注)最大1,440mg/日が投与された。
注)国内未承認
- ※1:スクリーニング期間は14日以内とし、スクリーニング前及びスクリーニング期間中にメチルプレドニゾロン換算で累積投与量が最大3gまでグルココルチコイドの静脈内投与を許容した。スクリーニング期間に経口グルココルチコイドが投与された場合、Day 1までにプレドニゾン換算で20mg/日以下に漸減することとした。
- ※2:プレドニゾン群では164例が治験薬を1回以上投与され、タブネオス群では全例が治験薬を投与された。治験薬を投与されなかったプレドニゾン群の1例は、腎生検の結果から血管炎と明確に診断されなかったため、治験担当医師の再考により治験を中止した。
- 【静注シクロホスファミド】用法及び用量
成人:通常、シクロホスファミド(無水物換算)として1日1回500~1000mg/m2(体表面積)を静脈内に注射する。原則として投与間隔を4週間とする。なお、年齢、症状により適宜増減する。
- 【経口シクロホスファミド】用法及び用量
- 通常、成人にはシクロホスファミド(無水物換算)として1日50~100mgを経口投与する。なお、年齢、症状により適宜増減する。
有効性評価項目
〔主要評価項目〕検証的解析項目
- ・26週時に疾患の寛解※3を達成した患者の割合
- ・52週時に疾患の寛解維持※4を達成した患者の割合(日本の承認時における主要評価項目)
- ※3:寛解の定義
26週時にバーミンガム血管炎活動性スコア(BVAS)=0を達成し、26週時の前4週間以内にANCA関連血管炎治療のためにグルココルチコイドを使用していない場合と定義 - ※4:寛解維持の定義
26週時に寛解を達成し、52週時まで再燃がない場合(52週時にBVAS=0であり、52週時の前4週間以内にANCA関連血管炎治療のためにグルココルチコイドを使用していないこと)と定義
〔副次評価項目〕
- ・26週間におけるGlucocorticoid Toxicity Index[GTI-Cumulative Worsening Score(GTI-CWS)及びGTI-Aggregate Improvement Score(GTI-AIS)]によって測定したグルココルチコイド誘発毒性
- ・26週間における各カテゴリーのGTI-CWS及びGTI-AIS
- ・腎病変を有する患者の52週間における推算糸球体濾過量(eGFR)の変化量
- ・52週間におけるShort Form-36(SF-36) version 2の各サマリースコア及びドメインスコアの変化量
- ・再燃※5した患者の割合及び再燃までの期間(26週時の寛解達成後もしくはBVAS=0の達成後) など
- ※5:再燃の定義
26週時に疾患の寛解(BVAS=0かつ26週時の前4週間以内にANCA関連血管炎治療のためにグルココルチコイドを使用していない)を達成した後、あるいは、いずれかの時点でBVAS=0を達成した後に、BVASの主要項目1個以上、BVASの主要項目以外の項目3個以上、又は連続2回の来院時に主要項目以外の項目1個もしくは2個に該当した場合と定義
〔サブグループ解析項目〕
- ・腎病変を有し、eGFRが30mL/min/1.73m2未満の患者の52週間におけるeGFRの変化量 など
〔日本人サブグループ解析項目〕
- ・26週時に疾患の寛解を達成した患者の割合及び52週時に疾患の寛解維持を達成した患者の割合
- ・26週間におけるGTI-CWS及びGTI-AISによって測定したグルココルチコイド誘発毒性
安全性評価項目
有効性評価項目としたグルココルチコイド誘発毒性以外の安全性評価項目は、以下の通りであった。
- ・試験治療下で発現した重篤な有害事象、有害事象、有害事象による中止の発現率 など
組み入れ基準
- ・チャペルヒル・コンセンサス会議(CHCC)の定義に従い、MPA又はGPAの臨床診断を受けた患者
- ・ANCA関連血管炎と新たに診断を受けた患者又はANCA関連血管炎が再発し、シクロホスファミド又はリツキシマブによる治療が必要とされた18歳以上の患者[許可された場合には青年期患者(12~17歳)の登録も可]
- ・BVASの主要項目1個以上、主要項目以外の項目3個以上、又は蛋白尿及び血尿に関する腎臓項目2個以上のいずれかに該当する患者
- ・eGFRが15mL/min/1.73m2以上(成人患者ではMDRD式※6、青年期患者では修正したSchwartz式※7を使用した)の患者
- ※6:MDRD(Modification of Diet in Renal Disease)式
eGFR(mL/min/1.73m2)=175×血清クレアチニン(mg/dL)-1.154×年齢-0.203(女性の場合:×0.742、黒人の場合:×1.212) - ※7:修正したSchwartz式
eGFR=(0.413×身長[cm])/血清クレアチニン(mg/dL)
【日本人成人におけるeGFRの計算式は日本特有のプロトコル補遺で以下のように定義】
eGFR(mL/min/1.73m2)=194×血清クレアチニン(mg/dL)-1.094×年齢-0.287(女性の場合:×0.739)
主な除外基準
- ・肺胞出血のため、侵襲的な肺換気補助を要する患者
- ・日本人については、重症の間質性肺炎を合併する患者
解析計画
有効性の主要評価項目の解析
有効性の主要評価項目は、26週時に疾患の寛解を達成した患者の割合及び52週時に疾患の寛解維持を達成した患者の割合とした。有効性の主たる解析対象集団はIntent-to-Treat(ITT)集団とした。有効性の主要評価項目について、タブネオス群とプレドニゾン群の群間差の両側95%CIの下限値が-20%を上回った場合、タブネオス群はプレドニゾン群に対して非劣性を示したと判断した。また、全体の第一種の過誤を制御するための手順を用いることで、有効性の主要評価項目について、タブネオス群とプレドニゾン群の群間差の両側95%CIの下限値が0.0%を上回った場合、タブネオス群はプレドニゾン群に対して優越性を示したと判断した。2つの主要評価項目と非劣性及び優越性の2つの検定の多重比較を調整するため、有効性の主要評価項目については、プレドニゾン群と比較したタブネオス群の非劣性及び優越性の多重仮説検定を考慮した階層的手法(検定順序:①26週時の非劣性②52週時の非劣性③52週時の優越性④26週時の優越性)を用いた。有効性の主要評価項目の非劣性検定とそれに続く優越性検定の両検定を考慮した、全体的な第一種の過誤の目標レベルは5%以内であった。有効性の主要評価項目の層別解析の非劣性及び優越性の検定には、要約スコア推定を用いた。層別因子は、無作為化の層別化で用いた因子と同じで、標準的な基礎治療(リツキシマブ又はシクロホスファミド)、ANCAの種類(MPO又はPR3陽性)、ANCA関連血管炎の病期(新規診断又は再燃)とした。タブネオス群とプレドニゾン群の寛解率の差の要約スコア推定値を、inverse-variance stratum weightとMiettinen-Nurminen(スコア)信頼限界を用いて、寛解率の差の信頼限界を、26週時に疾患の寛解を達成した患者の割合と52週時に疾患の寛解維持を達成した患者の割合について算出した。感度分析及び部分集団解析も実施した。なお、26週時に疾患の寛解を達成した患者の割合及び52週時に疾患の寛解維持を達成した患者の割合の群間差は要約スコア推定により評価した。
有効性の副次評価項目の解析
13週時と26週時のGTI-CWSとGTI-AISの主要解析を、反復測定混合効果モデル(MMRM)を用いてITT集団を対象に行った。GTI-CWS及びGTI-AISのモデルには投与群、時点、投与群と時点の交互作用及び層別因子[標準的な基礎治療(リツキシマブ又はシクロホスファミド)、ANCAの種類(MPO又はPR3陽性)、ANCA関連血管炎の病期(新規診断又は再燃)]を共変量として組み込んだ。モデルからの線形対比を用いて、13週時と26週時の群間差をそれぞれ検定した。SF-36 version 2の身体的サマリースコア、精神的サマリースコア、8つのドメインスコアの52週間における変化量について、ITT集団を対象に、投与群、時点、投与群と時点の交互作用及び層別因子、ベースライン値を共変量としたMMRMを用いて解析した。26週時に疾患の寛解を達成した後に再燃した患者の割合を要約した。BVAS=0を達成した後、試験中のいずれかの時点で再燃した患者の割合は要約スコア推定、再燃までの期間はLog-rank検定により評価した。eGFR※8の52週間における変化量について、SF-36 version 2の解析同様に、ITT集団を対象としてMMRMを用いて解析した。ベースラインのeGFR(<30、30~59、>59mL/min/1.73m2)に基づくeGFRの52週間における変化量についても評価した。また、26週間における各カテゴリーのGTI-CWS及びGTI-AISを検討した。
- ※8:BVASの腎臓項目に基づきベースライン時に腎病変を有する患者
有効性のサブグループ解析
有効性の副次評価項目におけるサブグループ解析として、腎病変を有し、eGFRが30mL/min/1.73m2未満の患者の52週間におけるeGFRの変化量を検討した。
有効性の日本人サブグループ解析
有効性の主要評価項目における日本人サブグループ解析として、26週時に疾患の寛解を達成した患者の割合及び52週時に疾患の寛解維持を達成した患者の割合を検討した。
有効性の副次評価項目における日本人サブグループ解析として、26週間におけるGTI-CWS及びGTI-AISによって測定したグルココルチコイド誘発毒性を検討した。
安全性評価項目の解析
副作用について各事象の発現例数及び発現率を算出した(日本人集団についてのサブグループ解析も実施した)。






