Jayne DR et al.:J Am Soc Nephrol 28:2756, 2017
COI:ChemoCentryx実施治験
試験概要
目的
活動性のANCA関連血管炎患者[顕微鏡的多発血管炎(MPA)、多発血管炎性肉芽腫症(GPA)又は腎限局型血管炎(RLV)患者※1]を対象に、経口グルココルチコイド(プレドニゾン注))を低用量又は併用しない条件下で、タブネオスの有効性及び安全性を検討する。
対象
活動性のMPA、GPA又はRLV患者67例
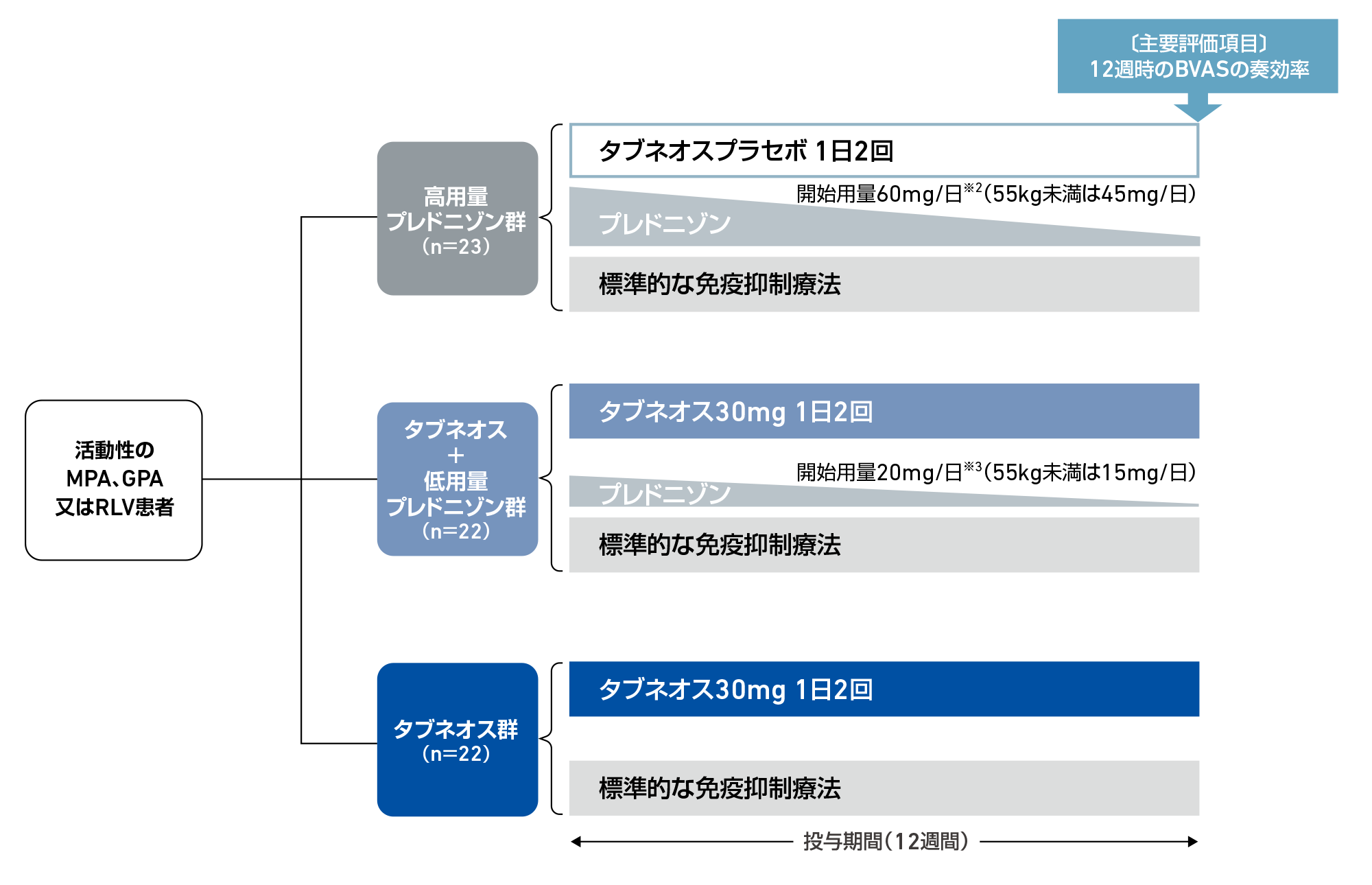
試験デザイン
多施設共同、無作為化、二重盲検、ダブルダミー、プラセボ対照試験
方法
対象患者を無作為に高用量プレドニゾン群、タブネオス+低用量プレドニゾン群又はタブネオス群の3群に割り付けた。高用量プレドニゾン群(23例)にはタブネオスプラセボ1日2回+高用量プレドニゾン(開始用量60mg/日)、タブネオス+低用量プレドニゾン群(22例)にはタブネオス30mg 1日2回+低用量プレドニゾン(開始用量20mg/日)、タブネオス群(22例)にはタブネオス30mg 1日2回(プレドニゾンなし)が12週間投与された。なお、すべての患者に標準的な免疫抑制療法として静注シクロホスファミド[15mg/kg(最大1.2g)を2~4週間ごと]又は静注リツキシマブ(375mg/m2を週1回、4週間)が投与された。
注)国内未承認
- ※1:ANCA陽性のRLVはMPAに分類される。
- ※2:試験デザインに沿ってプレドニゾンを12週間かけて60mg/日から10mg/日になるよう漸減投与した。
- ※3:試験デザインに沿ってプレドニゾンを12週間かけて20mg/日から5mg/日になるよう漸減投与した。
- 【静注シクロホスファミド】用法及び用量
成人:通常、シクロホスファミド(無水物換算)として1日1回500~1000mg/m2(体表面積)を静脈内に注射する。原則として投与間隔を4週間とする。なお、年齢、症状により適宜増減する。
有効性評価項目
〔主要評価項目〕
- ・12週時のバーミンガム血管炎活動性スコア(BVAS)の奏効率※4
※4:ベースラインからのBVASの低下率が50%以上であり、かついずれの項目にも悪化が認められない場合と定義
〔副次評価項目〕
- ・12週間におけるBVASの変化率 など
安全性評価項目
- ・有害事象、身体検査の異常、バイタルサイン、臨床検査(血液生化学検査、血液学的検査及び尿検査)、心電図 など
解析計画
Intent-to-Treat(ITT)集団は無作為化され、治験薬が1回以上投与されたベースライン以降に1回以上BVASで評価された全患者とした。安全性解析対象集団は無作為化され、治験薬が1回以上投与された全患者とした。データは、投与群、試験のステップ及び全体ごとに記述的に要約した。連続変数について、要約統計量には、患者数、平均値、中央値、標準偏差、平均値の標準誤差、最小値及び最大値を含めた。カテゴリー変数は頻度及び割合を示した。
有効性の主要評価項目の解析
主要解析は12週時のBVASの奏効率を算出し、各タブネオス群を高用量プレドニゾン群と比較した。12週時の結果が欠測の場合、患者にANCA関連血管炎の悪化が認められ救済治療を必要とした場合を除き、無作為化後の最終の結果を使用した。患者にANCA関連血管炎の悪化が認められ救済治療を必要とした場合、患者はノンレスポンダーとした。群間差(タブネオス群-高用量プレドニゾン群)の片側95%CIの下限値が-20%を上回った場合、それぞれのタブネオス群は高用量プレドニゾン群に対して非劣性を示したと判断した。下限値が0.0%を上回った場合、それぞれのタブネオス群は高用量プレドニゾン群に対して優越性を示したと判断した。片側95%CIの下限値が両側90%CIの下限値と同一であったため、データを示す目的で両側90%CIを表示した。非劣性(H1:p1-p2>-0.2)及び優越性(H1:p1-p2>0)の仮説検定に基づくp値も表示した。
有効性の副次評価項目の解析
カテゴリカルな有効性評価項目は、主要評価項目と同じ手法を用いて解析した。これには12週間におけるBVASの変化率が該当した。有効性の定量的変数は、ベースラインからの変化量及び/又は変化率(BVASの変化率については患者別データ推移を含む)として来院ごとに要約した。12週間の投与期間中の投与群を比較するため、Mixed Model for Repeated Measure(MMRM)を用いた。また、共分散分析を用いて、各来院時、12週間の投与期間終了時における変化量及び/又は変化率の投与群間の比較を行った。この方法で解析する変数はBVASの変化率であった。
安全性評価項目の解析
副作用について各事象の発現例数及び発現率を算出した。






