国内第Ⅲ相長期投与試験
試験概要
紹介する結果には承認用量と異なる成績が含まれていますが、承認時評価資料であるため掲載しています。
- 目的:
過活動膀胱(OAB)患者を対象にベオーバ50mg(100mgへの増量可能)を52週間長期投与した際の安全性及び有効性を検討する。 - 対象:
20歳以上のOAB患者169例(有効性解析対象例166例、安全性解析対象例167例) -
方法:
多施設共同非盲検非対照試験
観察期後に、ベオーバを52週間経口投与(1日1回朝食後)した。なお、本剤50mgを8週間投与した後、増量基準a)を満たす場合は本剤の用量を100mgに増量し、44週間経口投与(1日1回朝食後)した。
a)増量基準:治療薬の効果が不十分、かつ患者の安全性に問題ないと治験責任医師等が判断し、かつ患者も増量を希望する場合 - 安全性評価項目:
有害事象、臨床検査、バイタルサイン、12誘導心電図検査、残尿量 - 有効性評価項目:
各評価時点におけるベースラインからの変化量(1日平均排尿回数、1日平均尿意切迫感回数 他)など - 解析計画:
排尿パラメータは、LDA法を用いて、ベースラインからの変化量の最小二乗平均及び両側95%信頼区間の推定、並びに変化量0を帰無仮説とする1標本検定を行った。
以下、100mgは承認外の用量であるため、有効性に関する試験結果はベオーバ50mg維持例の結果のみ記載
社内資料:国内第Ⅲ相長期投与試験(T302試験)[承認時評価資料]
社内資料:国内第Ⅲ相長期投与試験(T302試験)[承認時評価資料]
安全性:副作用
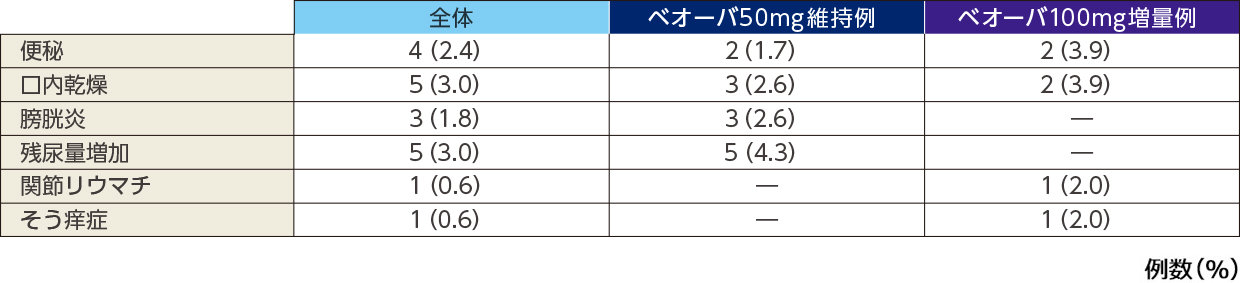
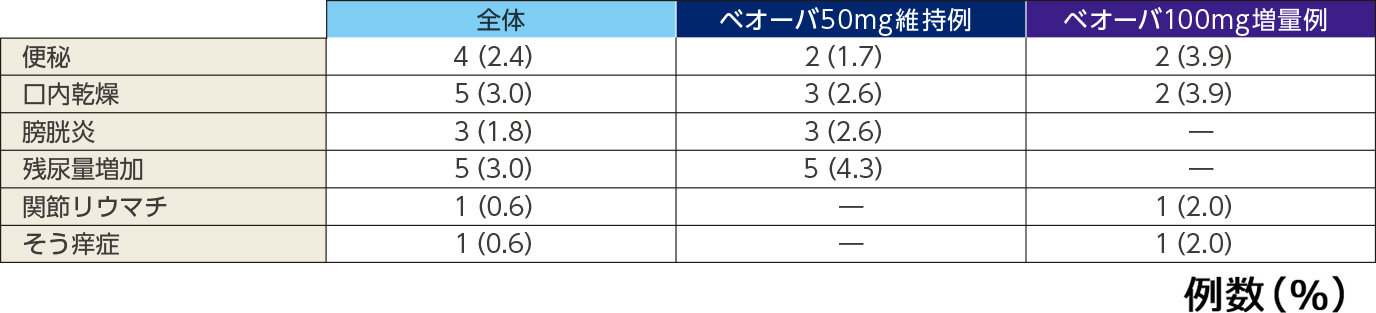
副作用


主な副作用(発現率1%以上)*
*いずれかの投与群で1%以上
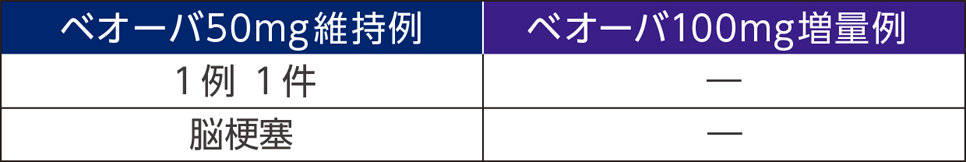
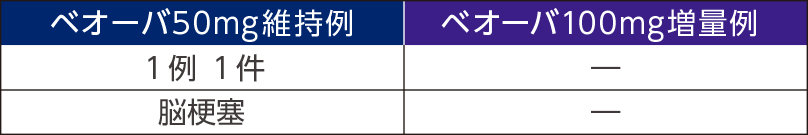
重篤な副作用
投与中止に至った副作用
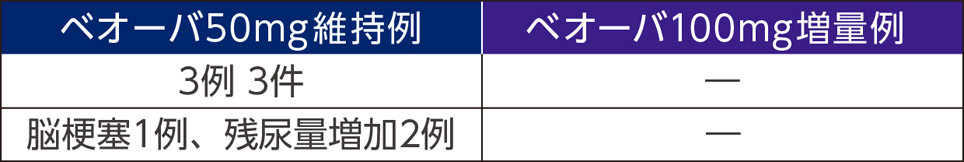
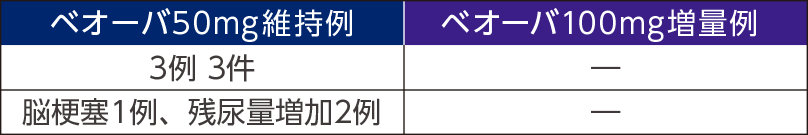
死亡例は50㎎維持例で1例(転倒)に認められたが、本剤との因果関係はなしと判断された。
バイタルサイン、残尿量のベースラインからの変化量の推移
バイタルサインへの影響
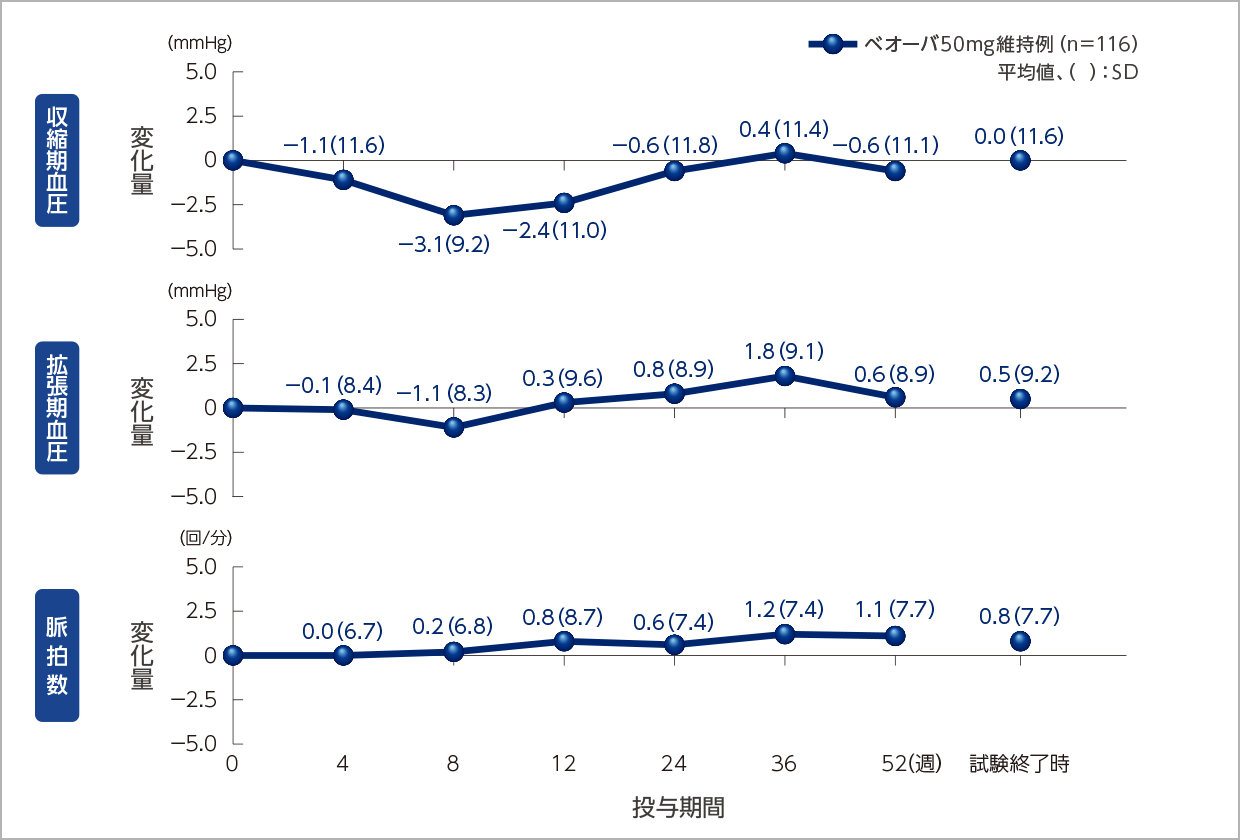
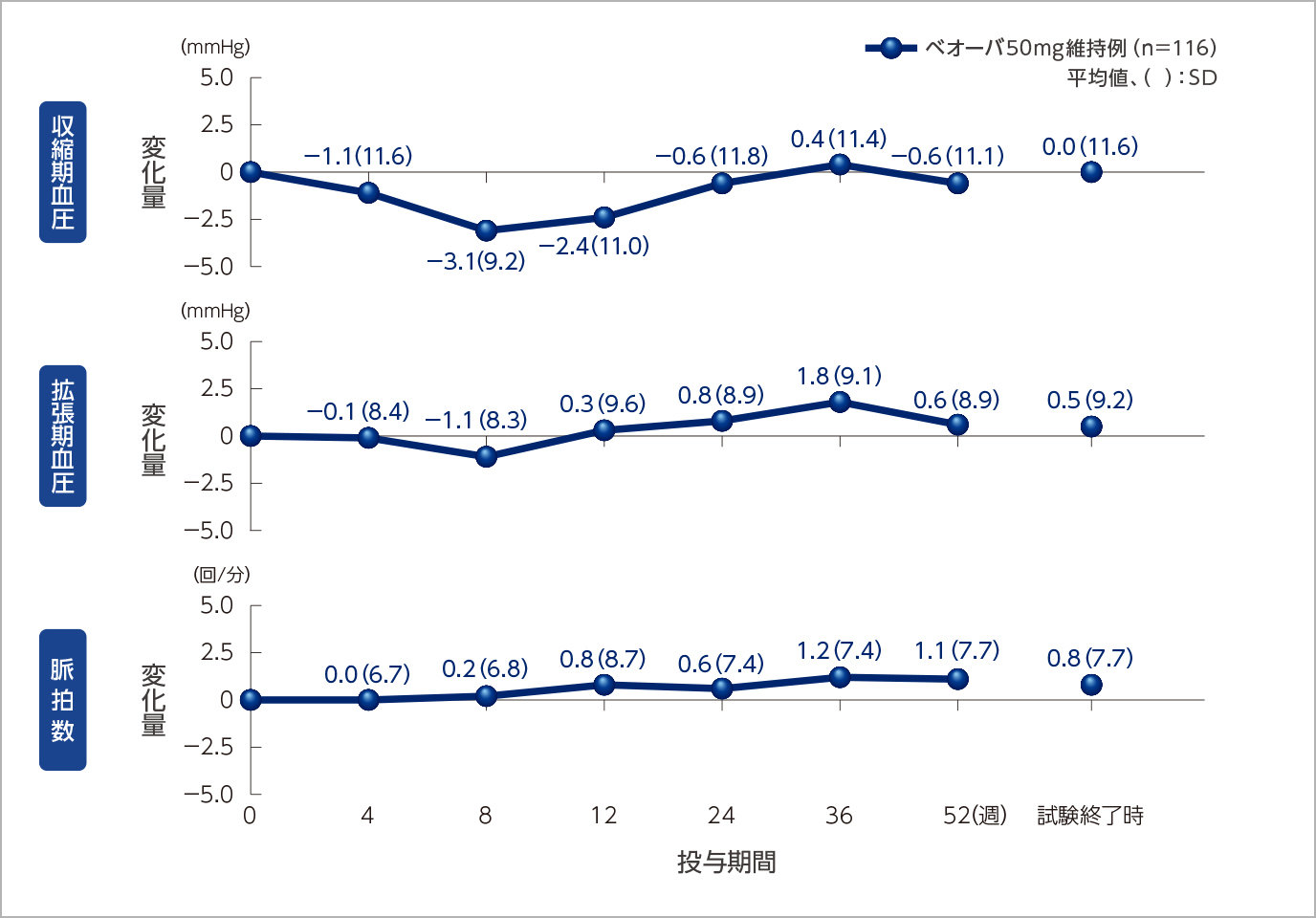
残尿量への影響
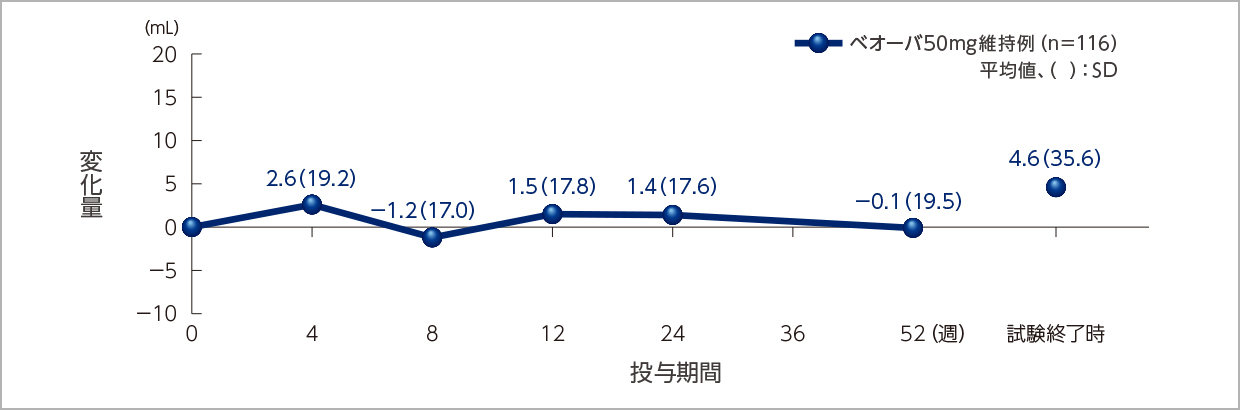
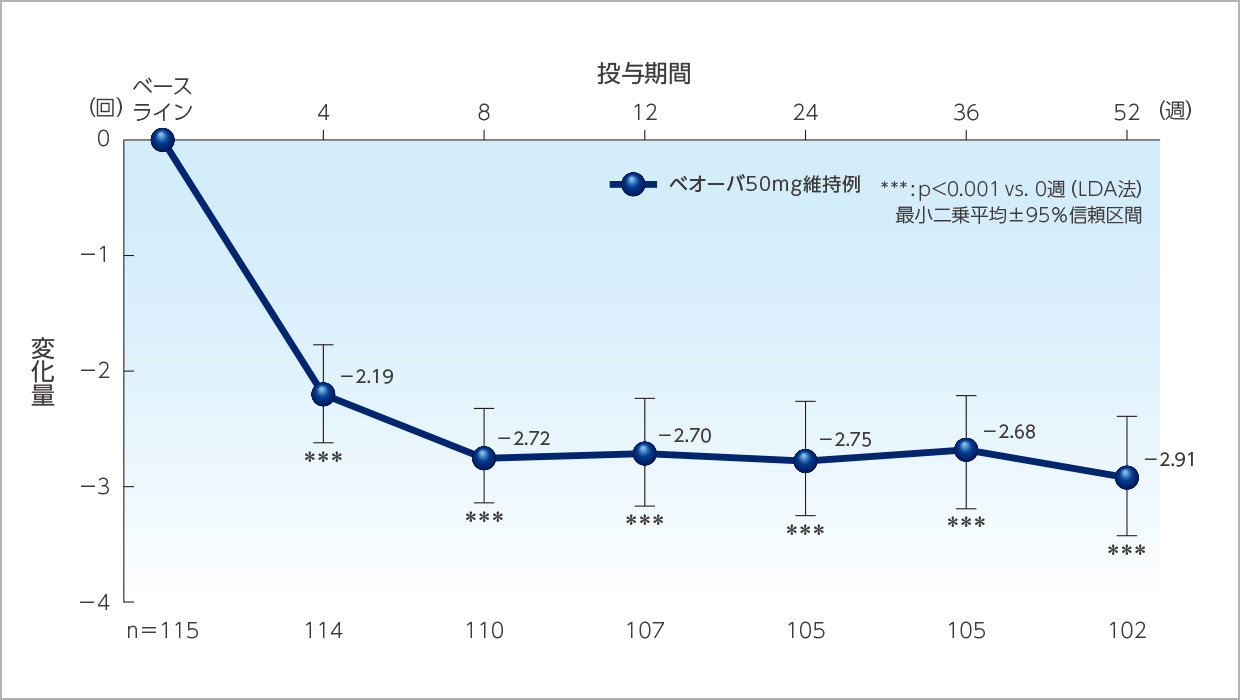
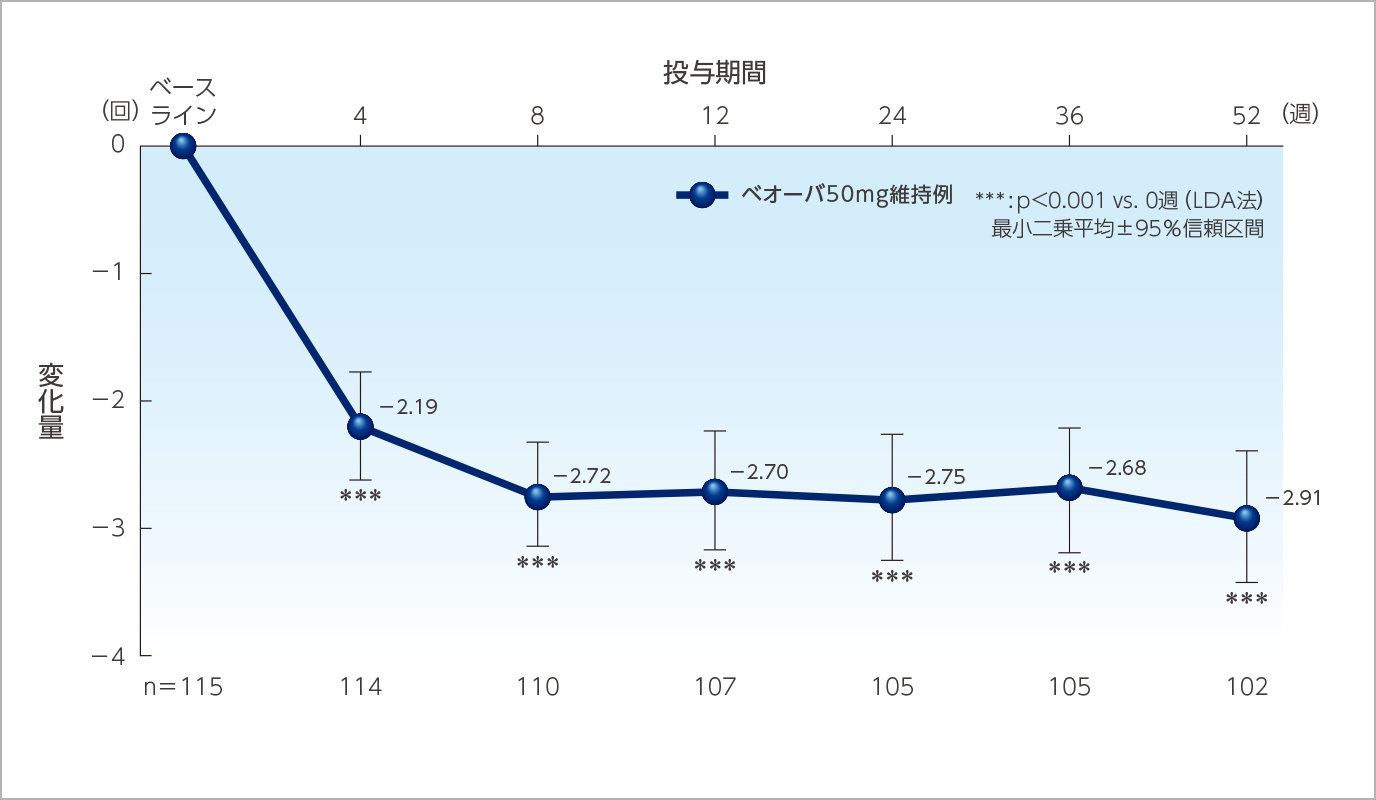
投与52週時までベオーバ®の効果は維持されました。
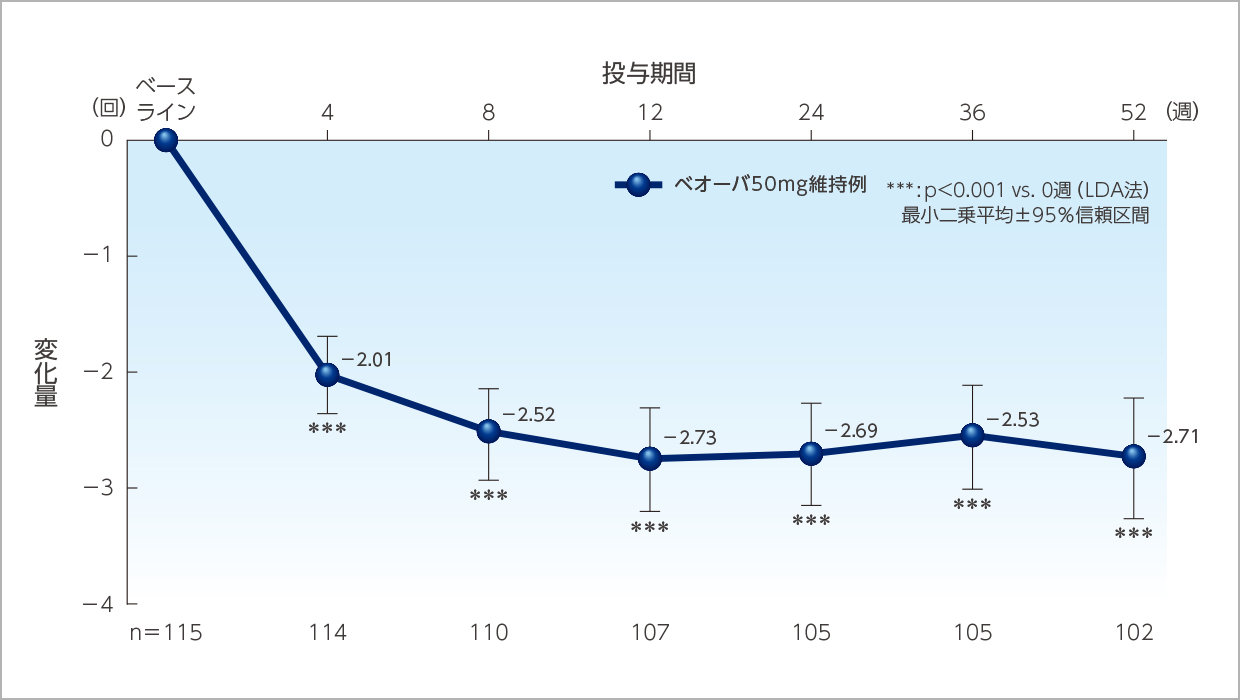
1日平均排尿回数のベースラインからの変化量の推移(ベオーバ50mg維持例)
1日平均尿意切迫感回数のベースラインからの変化量の推移(ベオーバ50mg維持例)
- 9. 特定の背景を有する患者に関する注意(添付文書抜粋)
- 9.1 合併症・既往歴等のある患者
- 9.1.1 重篤な心疾患のある患者心拍数増加等により、症状が悪化するおそれがある。
本剤の承認された用法・用量は「通常、成人にはビベグロンとして50mgを1日1回食後に経口投与する。」である。





