ベオーバ錠 Q&A
「Q&A」は、医療関係者の皆様に向けて作成しています。
本内容は、製品の適正使用に関する参考情報であり、すべてのケースに当てはまるものではありません。また、国内で承認された効能効果・用法用量の範囲外の情報を含む場合がありますが、当社として推奨するものではありません。製品のご使用にあたっては、最新の電子添文をご確認ください。
「Q&A」のご利用によって、生じた結果につきましては、責任を負いかねますのでご了承ください。
※許可なく複写、複製、転掲、改変等を行うことはご遠慮ください。
-
Q1.ベオーバ錠の製品特性を教えてください。
(1) β3アドレナリン受容体に対し選択的に作用し膀胱平滑筋を弛緩させ(in vitro)、膀胱容量を増大しました(カニクイザル)。 (2) 過活動膀胱における尿意切迫感、頻尿、切迫性尿失禁に対し、1日1回投与で有効性を示しました。 (3) 国内第Ⅲ相臨床試験※1において、QOLの指標となったキング健康調査票のすべての項目※2を改善しました。 ※1:国内第Ⅲ相比較試験(T301試験)及び国内第Ⅲ相長期投与試験(T302試験) ※2:全般的健康感、生活への影響、仕事・家事の制限、身体的活動の制限、社会的活動の制限、個人的な人間関係、心の問題、睡眠・活力及び重症度 (4) 52週投与まで尿意切迫感、頻尿、切迫性尿失禁に対する有効性は維持されました。 (5) 重大な副作用として尿閉が報告されています。主な副作用は、口内乾燥、便秘、尿路感染(膀胱炎 等)残尿量増加が報告されています。
電子添文の副作用及び臨床成績の安全性の結果をご参照ください。
4.効能又は効果 過活動膀胱における尿意切迫感、頻尿及び切迫性尿失禁 5.効能又は効果に関連する注意 5.1 本剤を適用する際、十分な問診により臨床症状を確認するとともに、類似の症状を呈する疾患(尿路感染症、尿路結石、膀胱癌や前立腺癌などの下部尿路における新生物等)があることに留意し、尿検査等により除外診断を実施すること。なお、必要に応じて専門的な検査も考慮すること。 5.2 下部尿路閉塞疾患(前立腺肥大症等)を合併している患者では、それに対する治療を優先させること。 6.用法及び用量 通常、成人にはビベグロンとして50mgを1日1回食後に経口投与する。
参考資料:
インタビューフォーム
〔2024年11月改訂〕-
Q2.ベオーバ錠の効能又は効果を教えてください。
ベオーバ錠の効能又は効果は「過活動膀胱における尿意切迫感、頻尿及び切迫性尿失禁」です。
なお、効能又は効果に関連する注意は、以下のとおりです。
5.1本剤を適用する際、十分な問診により臨床症状を確認するとともに、類似の症状を呈する疾患(尿路感染症、尿路結石、膀胱癌や前立腺癌などの下部尿路における新生物等)があることに留意し、尿検査等により除外診断を実施すること。なお、必要に応じて専門的な検査も考慮すること。 5.2下部尿路閉塞疾患(前立腺肥大症等)を合併している患者では、それに対する治療を優先させること。参考資料:
電子添文
〔2024年11月改訂〕-
Q3.ベオーバ錠の用法及び用量を教えてください。
「通常、成人にはビベグロンとして50mgを1日1回食後に経口投与する。」です。
参考資料:
電子添文
〔2024年11月改訂〕-
Q4.ベオーバ錠の用法は食後投与ですが、食事の影響はありますか?
健康成人男性8例にビベグロン50mgを単回経口投与したとき注)、空腹時に投与したときのCmax及びAUCinfは、食後に投与したときに比べ、それぞれ1.73及び1.40倍でしたが、tmax及びt1/2に影響は認められませんでした。
注)ベオーバ錠の承認されている用法及び用量は、「通常、成人にはビベグロンとして50mgを1日1回食後に経口投与する。」です。
参考資料:
電子添文
〔2024年11月改訂〕-
Q5.ベオーバ錠の重篤な心疾患のある患者への投与に関する注意事項を教えてください。
重篤な心疾患のある患者では、心拍数増加等により、症状が悪化するおそれがありますので、慎重に投与してください。
承認時までの臨床試験において、重篤な心疾患のある患者での使用経験がないため、安全性が確立していません。参考資料:
電子添文
インタビューフォーム
〔2024年11月改訂〕-
Q6.ベオーバ錠の腎機能障害患者への投与に関する注意事項を教えてください。
腎機能障害患者に対し、電子添文『9.特定の背景を有する患者に関する注意』の項にて、注意喚起はしていません。
ビベグロン100mg注)を単回経口投与したときのCmax及びAUCinfを健康成人と比べると、軽度の腎機能障害者(eGFR 90~60mL/min/1.73m2)ではそれぞれ1.96及び1.49倍、中等度の腎機能障害者(eGFR 60~30mL/min/1.73m2)ではそれぞれ1.68及び2.06倍、高度の腎機能障害者(eGFR 30mL/min/1.73m2未満)ではそれぞれ1.42及び1.83倍でした(外国人データ)。
注)ベオーバ錠の承認されている用法及び用量は、「通常、成人にはビベグロンとして50mgを1日1回食後に経口投与する。」です。
参考資料:
電子添文
〔2024年11月改訂〕-
Q7.ベオーバ錠の肝機能障害患者への投与に関する注意事項を教えてください。
高度の肝機能障害のある患者では、ビベグロンの血中濃度が上昇するおそれがありますので、慎重に投与してください。
承認時までの臨床試験において、高度の肝機能障害のある患者での使用経験がないため、安全性が確立していません。
健康成人(正常な肝機能を有する被験者)と中等度の肝機能障害(Child-Pughスコアが7~9)を有する男女(外国人)8例に、ビベグロン100mg注)を単回経口投与したときのCmax及びAUCinfを健康成人と比べると、中等度の肝機能障害者ではそれぞれ1.35及び1.27倍でした。注)ベオーバ錠の承認されている用法及び用量は、「通常、成人にはビベグロンとして50mgを1日1回食後に経口投与する。」です。
参考資料:
電子添文
インタビューフォーム
〔2024年11月改訂〕-
Q8.ベオーバ錠は妊婦に投与してもよいですか?
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合のみ投与してください。
承認時までの臨床試験において、妊婦は対象から除外していたため、妊娠中の投与に関する安全性は確立していません。また、動物実験(ラット)において胎児への移行が報告されています。<参考>
妊娠18日目のラットに[3H]ビベグロン10mg/kgを単回経口投与したところ、[3H]ビベグロン由来の放射能は、血液胎盤関門を通過し胎児へ移行しました。
妊婦又は妊娠している可能性のある女性には、患者(母体)に対する有益性と胎児への危険性を十分に考慮し投与してください。参考資料:
電子添文
インタビューフォーム
〔2024年11月改訂〕-
Q9.ベオーバ錠は授乳婦に投与してもよいですか?
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討してください。
承認時までの臨床試験において、授乳婦は対象から除外していたため、授乳中の投与に関する安全性は確立していません。また、動物実験(ラット)において乳汁中に移行することが報告されています。<参考>
分娩後の哺育中ラットに[3H]ビベグロン10mg/kgを単回経口投与したとき、乳汁中に放射能が認められました。乳汁中の最高濃度は血漿中のCmaxよりも低値でしたが、乳汁中からの消失は血漿と同様の推移を示し、投与後24時間の乳汁中放射能濃度は最高濃度の約1/4でした。参考資料:
電子添文
インタビューフォーム
〔2024年11月改訂〕-
Q10.ベオーバ錠は小児に投与してもよいですか?
小児等を対象とした臨床試験は実施していないため、低出生体重児、新生児、乳児、幼児又は小児に対する安全性は確立していません。
小児等は適応外となりますので、成人への投与をお願いします。参考資料:
電子添文
インタビューフォーム
〔2024年11月改訂〕-
Q11.ベオーバ錠は高齢者に投与してもよいですか?
一般に高齢者では生理機能が低下しているので、患者の状態を十分に観察しながら慎重に投与してください。
健康高齢男性(65~74歳、6例)にビベグロン100mg注)を、1日1回14日間反復経口投与したときのCmax及びAUC0-24は、健康成人男性(23~39歳、5例)と比べて、それぞれ1.88及び1.45倍でした。
注)ベオーバ錠の承認されている用法及び用量は、「通常、成人にはビベグロンとして50mgを1日1回食後に経口投与する。」です。
参考資料:
電子添文
〔2024年11月改訂〕-
Q12.ベオーバ錠と併用注意の薬剤を教えてください。
ビベグロンは、CYP3A4又はP-糖タンパク(P-gp)の基質であることが示唆されていますので、以下の薬剤との併用に注意してください。
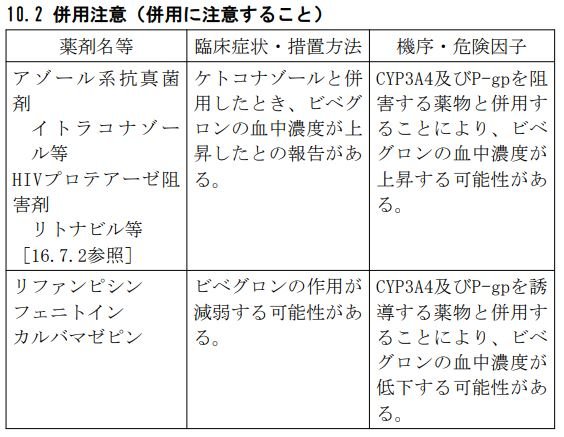
参考資料:
電子添文
〔2024年11月改訂〕-
Q13.ベオーバ錠の副作用を教えてください。
べオーバ錠の重大な副作用は尿閉(頻度不明)です。
また、その他の副作用は、以下のとおりです。
これらの副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行ってください。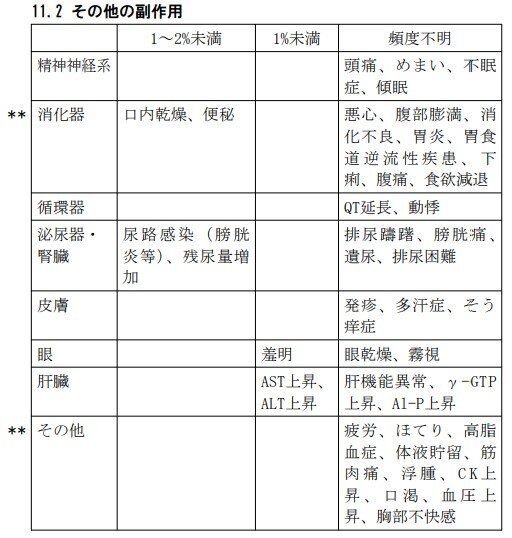
ベオーバ錠の第Ⅲ相臨床試験で認められた副作用は、以下のとおりです。
○国内第Ⅲ相プラセボ対照二重盲検比較試験
過活動膀胱患者1107例を対象にビベグロン50mg、100mg注)又はプラセボを、1日1回食後に12週間経口投与したときの副作用発現頻度は、ビベグロン50mg群で7.6%(28/370例)、100mg群で5.4%(20/369例)及びプラセボ群で5.1%(19/369例)でした。主な副作用は、50mg群で便秘1.6%(6/370例)、口内乾燥1.4%(5/370例)でした。○国内第Ⅲ相長期投与試験
過活動膀胱患者166例を対象に、ビベグロン50mgを1日1回食後に52週間経口投与しました。また、ビベグロン50mgを8週間投与した後、効果が不十分、かつ安全性に問題ないと治験担当医師が判断し、かつ被験者も増量を希望した場合に限り、1日1回100mg注)へ増量したときの副作用発現頻度は、ビベグロン50mg維持例で18.1%(21/116例)、100mg増量例で11.8%(6/51例)でした。主な副作用は、50mg維持例で残尿量増加4.3%(5/116例)、口内乾燥及び膀胱炎2.6%(3/116例)、便秘1.7%(2/116例)、100mg増量例で便秘及び口内乾燥3.9%(2/51例)、関節リウマチ及びそう痒症2.0%(1/51例)でした。注)ベオーバ錠の承認されている用法及び用量は、「通常、成人にはビベグロンとして50mgを1日1回食後に経口投与する。」です。
<参考>
ベオーバ錠の市販後の副作用の発現状況や概要等は、以下のリンクからご参照ください。■市販直後調査の結果報告※1■
■一般使用成績調査最終報告(2024年3月)※2■※1: 器官別大分類別、尿閉の性別の内訳と処置の内容の内訳、副作用の発現状況(投与量、投与期間、併用薬、合併症、発現時期、持続期間、転帰等)など ※2: 試験の要約、調査対象症例、投与状況・中止理由、副作用発現状況、重篤な副作用、尿閉及び関連有害事象の発現状況、背景要因別の尿閉及び関連有害事象の発現状況、前立腺肥大症合併症例における尿閉及び関連副作用の発現状況、残尿量、心血管系有害事象の発現状況、心血管系疾患合併症例における心血管系副作用の発現状況、背景要因別の副作用発現状況など
<補足>
尿閉は、ベオーバ錠のRMPにおける安全性検討事項の「重要な特定されたリスク」に挙げられています。
ベオーバ錠の医療従事者向けRMP資材は、以下のリンクから、ご参照ください。■【医療従事者向けRMP資材】ベオーバを適正にご使用いただくために■
参考資料:
電子添文
市販直後調査の結果報告
一般使用成績調査最終報告(2024年3月)
【医療従事者向けRMP資材】ベオーバを適正にご使用いただくために
〔2024年11月改訂〕-
Q14.ベオーバ錠の医薬品リスク管理計画書(RMP)及び関連資料はありますか?
ベオーバ錠のRMP及び関連資材は、以下のリンクからご参照ください。
■ベオーバ錠50mgに係る医薬品リスク管理計画書(RMP)■
■【医療従事者向けRMP資材】ベオーバを適正にご使用いただくために■なお、ベオーバ錠には、患者さん向けRMP資材はありません。
参考資料:
ベオーバ錠50mgに係る医薬品リスク管理計画書(RMP)
【医療従事者向けRMP資材】ベオーバを適正にご使用いただくために
〔2024年11月作成〕-
Q15.ベオーバ錠の代謝について教えてください。
ビベグロン経口投与後のヒト血漿中には、主に未変化体として存在し、代謝物として3種のグルクロン酸抱合体及び2種の酸化的代謝物が認められました(日本人及び外国人データ)。
参考資料:
電子添文
〔2024年11月改訂〕-
Q16.ベオーバ錠の排泄について教えてください。
健康成人男性6例に、14Cで標識したビベグロン100mg注)を単回経口投与したマスバランス試験の結果、投与後20日までに、投与放射能の20.3%が尿中に、59.2%が糞中に排泄されました。未変化体は尿中放射能の92.7%、糞中放射能の91.0%を占めました(外国人データ)。
注)ベオーバ錠の承認されている用法及び用量は、「通常、成人にはビベグロンとして50mgを1日1回食後に経口投与する。」です。
参考資料:
電子添文
〔2024年11月改訂〕-
Q17.ベオーバ錠の作用機序を教えてください。
膀胱平滑筋に存在するβ3アドレナリン受容体を選択的に刺激し、膀胱を弛緩させることで蓄尿機能を亢進し、過活動膀胱における尿意切迫感、頻尿、切迫性尿失禁を改善します。
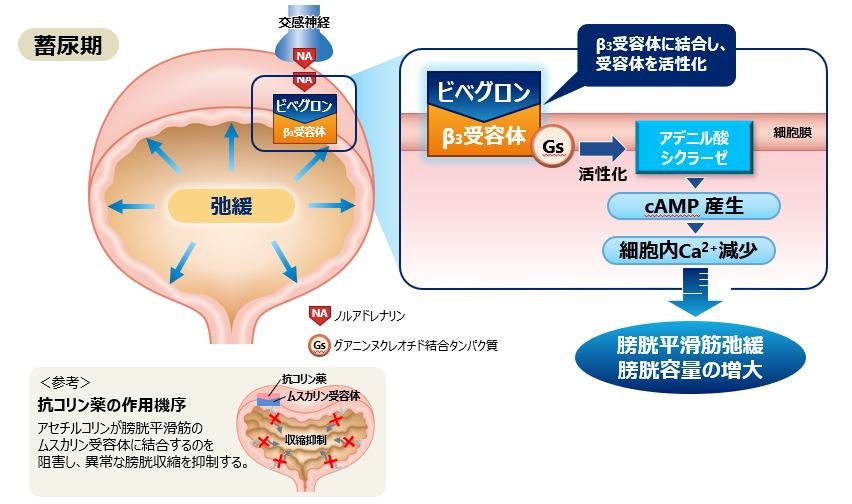
参考資料:
電子添文
インタビューフォーム
〔2024年11月改訂〕-
Q18.ベオーバ錠の製剤の安定性を教えてください。
ベオーバ錠の安定性は、以下のとおりです。
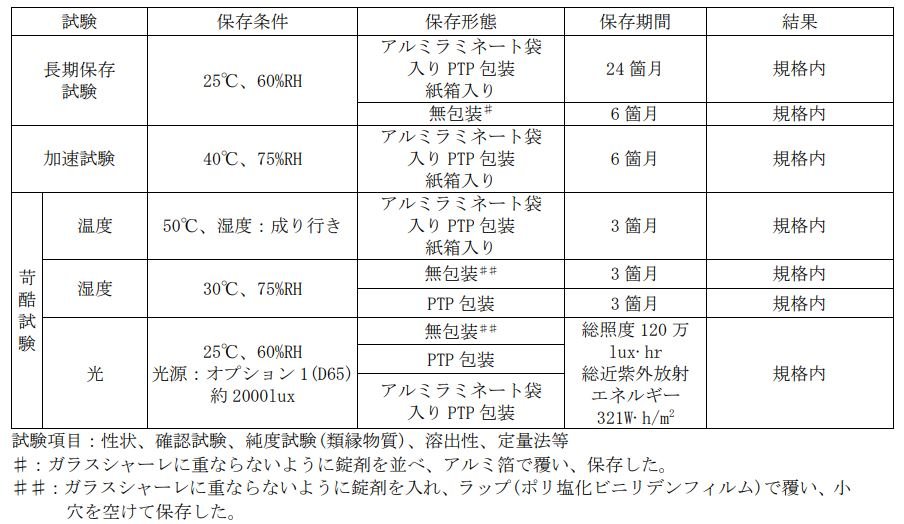
参考資料:
インタビューフォーム
〔2024年11月改訂〕-
Q19.ベオーバ錠の海外での承認・発売状況を教えてください。
ベオーバ錠50mgは、韓国で承認されています(2024年9月現在)。
【補足】
韓国では、杏林製薬株式会社(製造販売元)とライセンス契約のある企業(Jeil社)が承認を受けています。
米国では、有効成分であるビベグロンについて、キッセイ薬品工業株式会社(販売元)及び杏林製薬株式会社(製造販売元)とライセンス契約のない企業(Urovant Sciences, Inc.)が承認を受けていますが、本邦とは用法及び用量等が異なります。本邦におけるベオーバ錠の承認されている効能又は効果、用法及び用量は以下のとおりです。
4.効能又は効果
過活動膀胱における尿意切迫感、頻尿及び切迫性尿失禁5.効能又は効果に関連する注意
5.1本剤を適用する際、十分な問診により臨床症状を確認するとともに、類似の症状を呈する疾患(尿路感染症、尿路結石、膀胱癌や前立腺癌などの下部尿路における新生物等)があることに留意し、尿検査等により除外診断を実施すること。なお、必要に応じて専門的な検査も考慮すること。 5.2下部尿路閉塞疾患(前立腺肥大症等)を合併している患者では、それに対する治療を優先させること。6.用法及び用量
通常、成人にはビベグロンとして50mgを1日1回食後に経口投与する。参考資料:
インタビューフォーム
〔2024年11月改訂〕-
Q20.ベオーバ錠の粉砕、崩壊・懸濁性及び経管チューブの通過性に関する情報を教えてください。
本内容には承認を受けていない品質に関する情報が含まれています。試験方法等が確立していない内容も含まれており、あくまでも記載されている試験方法で得られた結果を事実として提示しています。医療従事者が臨床適用を検討する上での参考情報であり、加工等の可否を示すものではありません。
インタビューフォーム XIII.備考「1.調剤・服薬支援に際して臨床判断を行うにあたっての参考情報」に掲載しております。
以下のリンクから、ご参照ください。■粉砕品の安定性■
■崩壊・懸濁性及び経管チューブの通過性■注:ベオーバ錠の承認されている用法及び用量は、「通常、成人にはビベグロンとして50mgを1日1回食後に経口投与する。」です。粉砕又は懸濁して投与する方法は、ベオーバ錠の承認された用法及び用量ではありません。また、ベオーバ錠を粉砕又は懸濁した製品での臨床試験、薬物動態、安定性、有効性及び安全性等のデータはなく、ベオーバ錠の粉砕投与及び懸濁投与は推奨しません。
参考資料:
インタビューフォーム
〔2024年11月改訂〕





