海外第Ⅰ相QT/QTc評価試験(外国人データ)
試験概要
- 目的:
臨床用量を超える用量のベオーバを投与したときのQTc間隔への影響を検討する。 - 対象:
18歳以上55歳以下の、非喫煙、BMIが32.0kg/m2以下である健康成人男女52例(男女各26例) -
方法:
無作為化二重盲検プラセボ及び陽性対照4群4期クロスオーバー試験
ベオーバ200mg、400mg、モキシフロキサシン400mg(陽性対照)、プラセボのいずれかを空腹時に単回投与した。各期の休薬期間は14日以上とした。 - 主要評価項目:
QTcF[Fridericia 法で補正したQT]に対するベオーバの影響(ベオーバ各投与群及びモキシフロキサシン群の各投与期のQTcFのベースラインからの変化量とプラセボ投与群の各投与期のQTcFのベースラインからの変化量との差の最小二乗平均及び90%信頼区間) - 副次評価項目
QT/Qtc評価試験の分析感度 - 安全性評価項目:
有害事象、臨床検査値、バイタルサイン、12誘導心電図 - 解析計画:
主要評価項目であるQTcFに対するベオーバの影響について、反復測定混合効果モデルを用いて解析した。各時点において、QTcFのベースラインからの変化量のベオーバ各投与群とプラセボ群との平均差の最小二乗平均及び両側90%信頼区間を算出した(ベオーバ投与群間の多重性の調整は閉手順を用いた)。ベオーバ群とプラセボ群との差の90%信頼区間の上限がすべて10msecを下回る場合、ベオーバ単回投与はその用量では臨床的意義のある程度までQTc 間隔を延長しないとの仮説が支持されるものとした。
社内資料:海外第Ⅰ相QT/QTc 評価試験(012試験)[承認時評価資料]
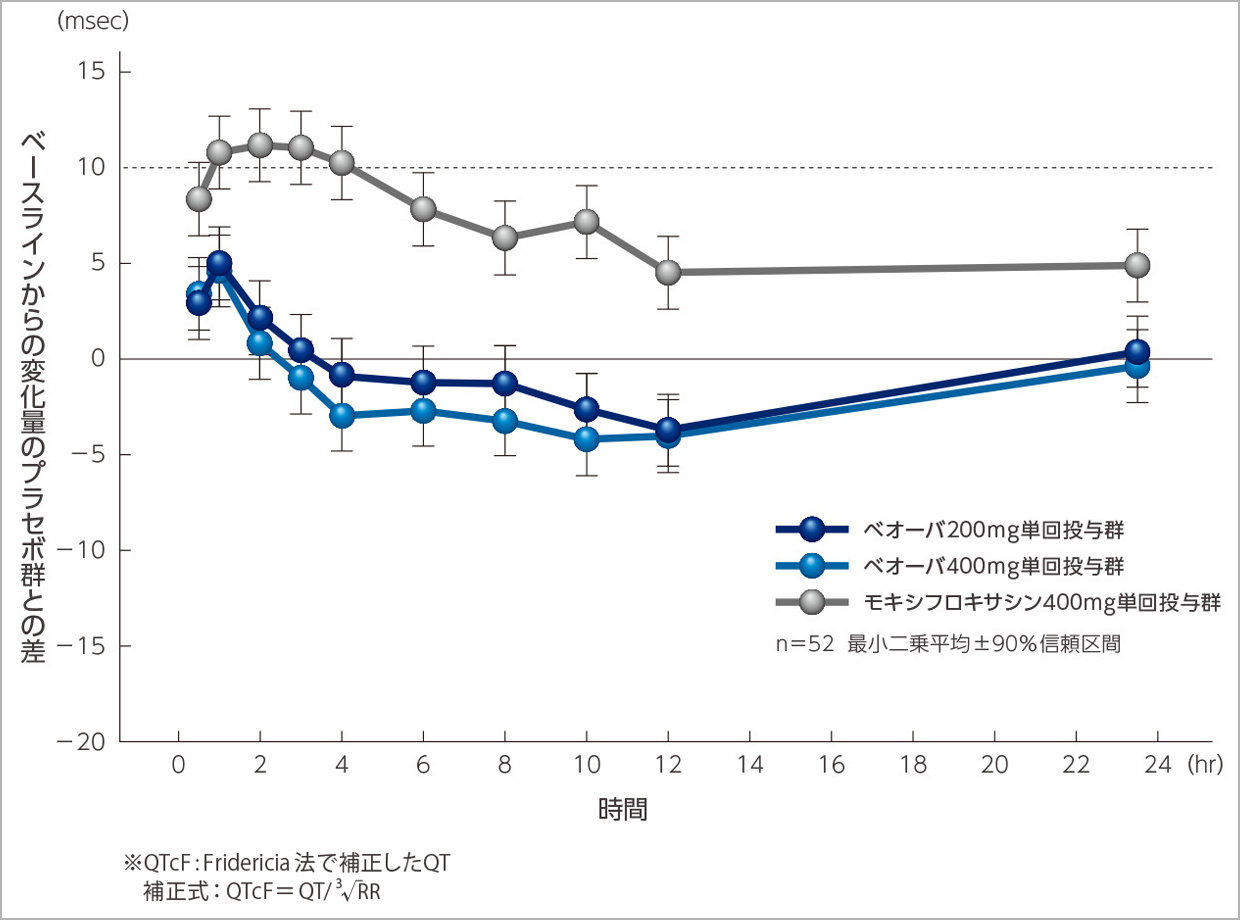
ベオーバ200mg群及び400mg群のQTcFのベースラインからの変化量に対するプラセボ群との差は共に投与後1時間で最大となり、最小二乗平均[90%信頼区間]はそれぞれ4.98msec[3.07,6.88msec]及び4.60msec[2.71,6.48msec]でした。また、ベオーバ投与のすべての時点で差の最小二乗平均の90%信頼区間の上限は10msecを下回りました。
QTcF※のベースラインからの変化量のプラセボ群との差
(最小二乗平均±90%信頼区間)の経時推移(主要評価項目)
安全性
副作用発現率は、安全性解析対象例52例中、べオーバ200mg群8.0%(4/50例)、べオーバ400mg群7.7%(4/52例)、モキシフロキサシン400mg群0%(0/51例)、プラセボ群2.0%(1/51例)であった。主な副作用は、べオーバ200mg群では鼓腸及び潮紅各2例(4.0%)、悪心、味覚異常、頭痛各1例(2.0%)、べオーバ400mg群では悪心及び潮紅各2例(3.8%)、プラセボ群では頭痛1例(2.0%)であった。
本試験において死亡、重篤な副作用及び中止に至った副作用はいずれの投与群でも認められなかった。
副作用発現率は、安全性解析対象例52例中、べオーバ200mg群8.0%(4/50例)、べオーバ400mg群7.7%(4/52例)、モキシフロキサシン400mg群0%(0/51例)、プラセボ群2.0%(1/51例)であった。主な副作用は、べオーバ200mg群では鼓腸及び潮紅各2例(4.0%)、悪心、味覚異常、頭痛各1例(2.0%)、べオーバ400mg群では悪心及び潮紅各2例(3.8%)、プラセボ群では頭痛1例(2.0%)であった。
本試験において死亡、重篤な副作用及び中止に至った副作用はいずれの投与群でも認められなかった。
- 9. 特定の背景を有する患者に関する注意(添付文書抜粋)
- 9.1 合併症・既往歴等のある患者
- 9.1.1 重篤な心疾患のある患者心拍数増加等により、症状が悪化するおそれがある。





