タブネオスカプセル Q&A
「Q&A」は、医療関係者の皆様に向けて作成しています。
本内容は、製品の適正使用に関する参考情報であり、すべてのケースに当てはまるものではありません。また、国内で承認された効能効果・用法用量の範囲外の情報を含む場合がありますが、当社として推奨するものではありません。製品のご使用にあたっては、最新の電子添文をご確認ください。
「Q&A」のご利用によって、生じた結果につきましては、責任を負いかねますのでご了承ください。
※許可なく複写、複製、転掲、改変等を行うことはご遠慮ください。
-
Q1.タブネオスカプセルの製品特性を教えてください。
1) 補体活性化の最終段階で産生されるC5a受容体(C5aR)を、選択的に阻害する経口薬です。 2) 国際共同第Ⅲ相試験(ADVOCATE試験)※1において、アバコパンのプレドニゾン注)群に対する26週時の寛解※2割合における非劣性(p<0.0001)及び日本の承認時での主要評価項目である52週時の寛解維持※3割合における優越性(p=0.0066)が検証されました。 3) 主要な消失経路は、第一相反応による酸化代謝とそれに続く代謝物の胆汁排泄(糞中:約77%、尿中:約10%)です。 4) 重大な副作用として、肝機能障害、重篤な感染症が報告されています。
電子添文の副作用及び臨床成績の安全性の結果をご参照ください。 注)国内未承認※1:活動性のMPA及びGPA患者331例(日本人21例含む)を対象に、アバコパンとプレドニゾンを比較した52週間の無作為化二重盲検実薬対照の臨床試験 ※2:26週時にバーミンガム血管炎活動性スコア(BVAS)=0を達成し、26週時の前4週間以内に、ANCA関連血管炎治療のためにグルココルチコイドを使用していない場合と定義 ※3:26週時に寛解を達成し、52週時まで再燃がない場合(52週時にBVAS=0であり、52週時の前4週間以内に、ANCA関連血管炎治療のためにグルココルチコイドを使用していないこと)と定義 参考資料:
インタビューフォーム
〔2024年11月改訂〕-
Q2.タブネオスカプセルの用法は食後投与ですが、食事の影響はありますか?
日本人健康成人男性8例における食事(低脂肪食)の影響を検討した結果注)、Tmax(空腹時:1.50時間、食後:2.50時間)及びt1/2(空腹時:44.3時間、食後:109時間)に影響を及ぼし、食後投与時のCmax及びAUC0-∞は、空腹時投与に比較してそれぞれ約1.08及び2.11倍でした。
白人健康成人男性16例における食事(高脂肪食)の影響を検討した結果注)、Tmax(空腹時:2.01時間、食後:6.00時間)及びt1/2(空腹時:73.5時間、食後:97.6時間)に影響を及ぼし、食後投与時のCmax及びAUC0-∞は、空腹時投与に比較してそれぞれ約1.08及び1.72倍でした(外国人データ)。注)タブネオスカプセルの承認されている用法及び用量は、「通常、成人にはアバコパンとして1回30 mgを1日2回朝夕食後に経口投与する。」です。
参考資料:
電子添文
〔2024年11月改訂〕-
Q3.タブネオスカプセルを飲み忘れた場合、どうすればよいですか?
飲み忘れた場合は、その回の服用は避けて、次の服用時間に1回分を飲んでください。絶対に2回分を一度に飲んではいけません。
参考資料:
タブネオスカプセルを服用される患者さまへ
〔2024年11月改訂〕-
Q4.タブネオスカプセルの『重要な基本的注意』に「本剤の投与中はニューモシスティス肺炎に対する適切な予防措置を考慮すること。」と、記載されている理由を教えてください。
第Ⅲ相試験は、ニューモシスティス感染に対する、抗生物質の予防投与を治験期間中に行うことが、治験実施計画書に規定されていました。同試験では、ニューモシスティス感染は認められなかったものの、ニューモシスティス感染に対する予防投与を行っていない状況下でのタブネオスカプセルの使用経験はないため、設定しました。
顕微鏡的多発血管炎、多発血管炎性肉芽腫症に関する診療ガイドランである「ANCA関連血管炎の診療ガイドライン2017(厚生労働省難治性疾患克服研究事業、2017年2月発行)」において、血管炎患者が強力な免疫抑制療法によりニューモシスティス肺炎を発症するおそれがあることが述べられており、ニューモシスティス肺炎発症予防のため、ST合剤投与など積極的な予防措置が推奨されています。タブネオスカプセルと免疫抑制剤との併用が想定されることから、タブネオスカプセル投与中にニューモシスティス肺炎に対する予防措置の実施を考慮する必要があります。参考資料:
電子添文
インタビューフォーム
〔2024年11月改訂〕-
Q5.タブネオスカプセルの腎機能障害患者への投与に関する注意事項を教えてください。
腎機能障害患者に対し、電子添文『 9. 特定の背景を有する患者に関する注意』の項にて、注意喚起はしていません。
アバコパンを投与された368例(日本人51例を含む)を対象とした、母集団薬物動態解析の結果より、軽度から重度の腎障害を有する患者におけるアバコパンのAUCτ,ssは、正常な腎機能の患者とおおむね同様でした。
参考資料:
電子添文
〔2024年11月改訂〕-
Q6.タブネオスカプセルの肝機能障害患者への投与に関する注意事項を教えてください。
アバコパンは、主に肝臓で代謝されます。
重度の肝機能障害(Child-Pugh分類:C)のある患者では、肝機能が悪化するおそれがあるので、患者の状態を十分に観察しながら慎重に投与してください。
なお、重度の肝機能障害患者(Child-Pugh分類:C)を対象とした臨床試験は、実施していません。軽度から中等度の肝機能障害患者15例(Child-Pugh分類:A及びB)にタブネオスカプセル30mgを単回経口投与したとき注)、アバコパン及び主要代謝物であるM1のCmax及びAUC0-∞は肝機能正常者と比較していずれも1.3倍以内の増加でした(外国人データ)。
注)タブネオスカプセルの承認されている用法及び用量は、「通常、成人にはアバコパンとして1回30 mgを1日2回朝夕食後に経口投与する。」です。
参考資料:
電子添文
〔2024年11月改訂〕-
Q7.タブネオスカプセル投与中に肝機能検査値の上昇が認められた場合の対応を教えてください。
タブネオスカプセル投与中に肝機能検査値の上昇が認められた場合には、タブネオスカプセルの休薬を検討してください。
なお、タブネオスカプセルの投与により、肝機能障害があらわれることがあるので、タブネオスカプセルの投与開始前及び投与期間中は、定期的に肝機能検査を行い、患者の状態を十分に観察してください。参考資料:
電子添文
インタビューフォーム
〔2024年11月改訂〕-
Q8.タブネオスカプセルは高齢者に投与してもよいですか?
高齢者に対し、電子添文『 9. 特定の背景を有する患者に関する注意』の項にて、注意喚起はしていません。
日本人及び外国人被験者368例(ANCA関連血管炎患者232例を含む)を対象とした母集団薬物動態解析の結果より、アバコパンの血漿中濃度に対して臨床的に、考慮すべき年齢の影響はみられませんでした。
参考資料:
インタビューフォーム
〔2024年11月改訂〕-
Q9.タブネオスカプセルと併用注意の薬剤はありますか?
アバコパンは、主としてCYP3A4により代謝されます。また、CYP3A4に対して中程度の阻害作用を有します。
以下の薬剤との併用に注意してください。
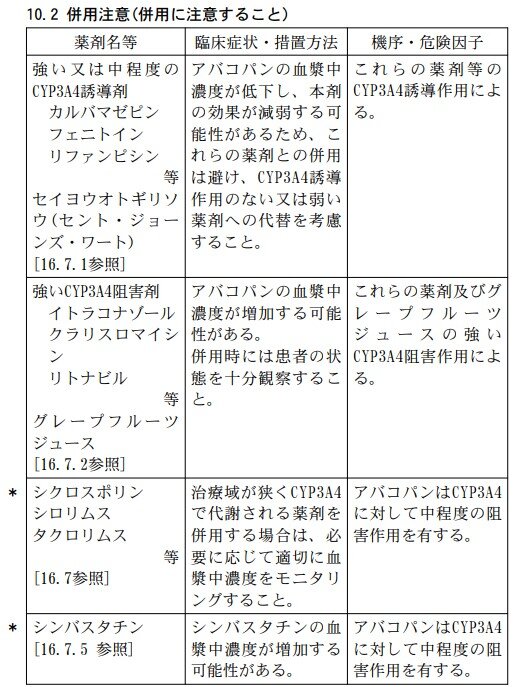
参考資料:
電子添文
〔2024年11月改訂〕-
Q10.タブネオスカプセルの副作用を教えてください。
タブネオスカプセルの重大な副作用は、肝機能障害と、重篤な感染症があります。
肝機能障害では、肝細胞損傷(0.6%)、胆汁うっ滞性肝炎(0.6%)等の重篤な肝胆道系障害(2.4%)、および重篤な肝機能検査値上昇(1.2%)が、重篤な感染症では、肺炎(1.2%)等があらわれることがあります。
また、その他の副作用は、以下のとおりです。
これらの副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には、投与を中止するなど適切な処置を行ってください。
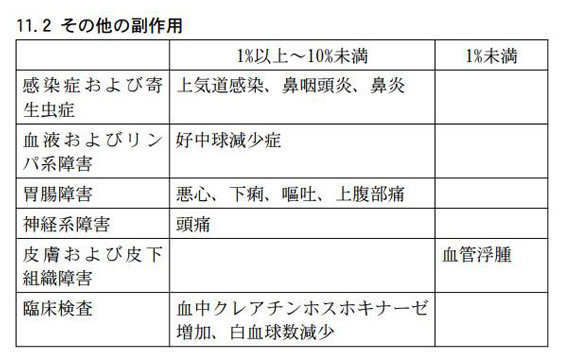
タブネオスカプセルの国際共同第Ⅲ相試験(ADVOCATE試験)で認められた副作用は、以下のとおりです。
活動性の顕微鏡的多発血管炎及び多発血管炎性肉芽腫症患者注)331例(日本人21例を含む)を対象に、タブネオスカプセルとプレドニゾンを比較する52週間の無作為化、二重盲検、ダブルダミー、実薬対照、第Ⅲ相試験を実施しました。タブネオスカプセル群の被験者(166例)には、タブネオスカプセル1回30mgを 1日2回で52週間投与しました。
タブネオスカプセル群の副作用発現頻度は60.2%(100/166例)でした。主な副作用は、悪心(6.6%)、上気道感染、頭痛(各6.0%)、下痢、嘔吐及び関節痛(各4.2%)でした。注)以下の基準を満たす患者を対象としました。
・シクロホスファミド又はリツキシマブによる治療を要する、新規診断又は再燃患者
・ANCA陽性の患者
・BVASの主要項目1つ以上、主要項目以外の項目3つ以上、又は蛋白尿及び血尿に関する腎臓項目2つ以上のいずれかに該当する、疾患活動性を有する患者(BVASの主要項目は、壊疽、上/強膜炎、網膜変化(血管炎/血栓症/滲出物/出血)、感音性難聴、大量喀血/肺胞出血、呼吸不全、虚血による腹痛、血清クレアチニン増加>30%あるいはクレアチニンクリアランス低下>25%、髄膜炎、脳卒中、脊髄病変、脳神経麻痺、感覚性末梢神経障害、運動性多発性単神経炎、赤血球円柱及び/又は糸球体腎炎と設定しました。)
・eGFR 15mL/min/1.73m2以上の患者
また、以下の患者を除外しました。
・肺胞出血のため、侵襲的な肺換気補助を要する患者
・日本人については、重症の間質性肺炎を合併する患者参考資料:
電子添文
〔2024年11月改訂〕-
Q11.タブネオスカプセルの医薬品リスク管理計画書(RMP)及び関連資料はありますか?
タブネオスカプセルのRMPは、以下のリンクからご参照ください。
■タブネオスカプセル10mgに係る医薬品リスク管理計画書(RMP)■
なお、タブネオスカプセルには、医療従事者向け及び患者さん向けRMP資材はありません。
参考資料:
タブネオスカプセル10mgに係る医薬品リスク管理計画書(RMP)
〔2024年11月作成〕-
Q12.タブネオスカプセルの代謝について教えてください。
アバコパンは、主にCYP3A4、その他2D6、2C19、2C8、2B6等を介して、肝臓で酸化的に代謝されます(in vitro 試験)。
健康成人に[14C]アバコパン100mg注)を経口投与したとき、血漿中にはアバコパン及びM1(メチル基の水酸化体)を含む複数の第一相代謝物が検出されました。血漿中総放射能に対して血漿中のアバコパン及びM1の占める割合は、それぞれ約18%及び約12%でした(外国人データ)。なお、主要代謝物であるM1は、アバコパンと同程度の薬理活性を有します。注)タブネオスカプセルの承認されている用法及び用量は、「通常、成人にはアバコパンとして1回30 mgを1日2回朝夕食後に経口投与する。」です。
参考資料:
電子添文
〔2024年11月改訂〕-
Q13.タブネオスカプセルの排泄について教えてください。
健康成人に[14C]アバコパン100mg注)を経口投与したとき、放射能の尿中総排泄率は投与量の約10%、糞中総排泄率は投与量の約77%でした。
また、アバコパン(未変化体)の尿及び糞中総排泄率は、それぞれ0.1%未満及び7%でした(外国人データ)。注)タブネオスカプセルの承認されている用法及び用量は、「通常、成人にはアバコパンとして1回30 mgを1日2回朝夕食後に経口投与する。」です。
参考資料:
電子添文
〔2024年11月改訂〕-
Q14.タブネオスカプセルの作用機序について教えてください。
アバコパンは、選択的C5a受容体(C5aR)拮抗作用によってC5a-C5aRシグナルを介した好中球のプライミングを抑制します。それにより、好中球によって誘発されるANCAを介した血管炎の増幅を緩和させ、ANCA関連血管炎の病態を改善します。
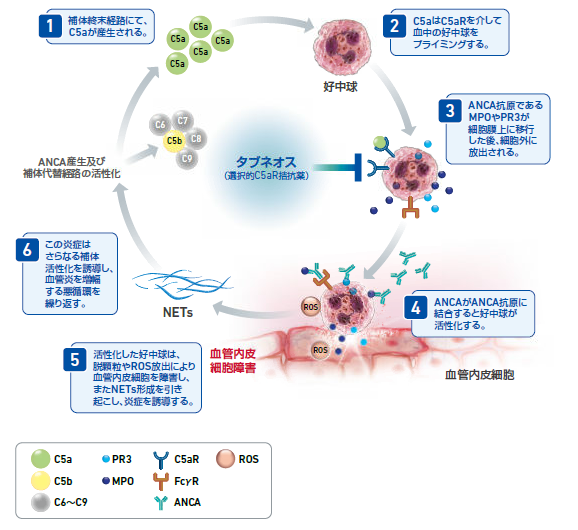
参考資料:
電子添文
インタビューフォーム
〔2024年11月改訂〕-
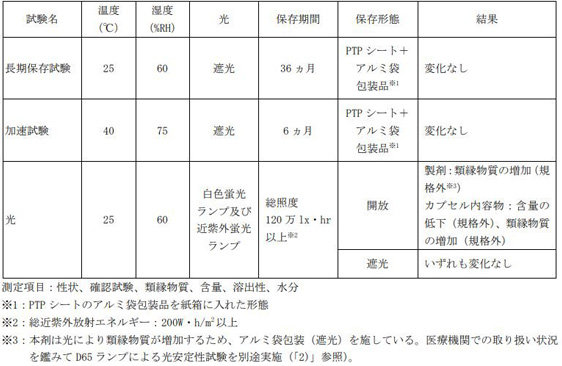
Q15.タブネオスカプセルの製剤の安定性を教えてください。
タブネオスカプセルの安定性は、以下のとおりです。
1)タブネオスカプセル10mgの各種条件下における安定性
2)タブネオスカプセル10mgの無包装及びアルミ袋包装開封後の安定性
「錠剤・カプセル剤の無包装状態での安定性試験法について(答申)(日本病院薬剤師会)(平成11年8月20日付)」の評価方法に準じた安定性情報を以下に示す。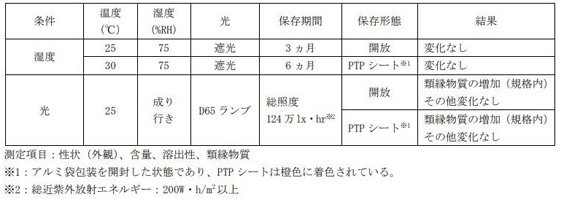
参考資料:
インタビューフォーム
〔2024年11月改訂〕-
Q16.タブネオスカプセルの海外での承認・発売状況を教えてください。
タブネオスカプセルの海外での承認・発売状況は以下のとおりです(2024年8月時点)。
【発売年月】米国: 2021年10月 EU: 2022年2月(ドイツ)
2022年3月(オーストリア)他参考資料:
インタビューフォーム
〔2024年11月改訂〕-
Q17.タブネオスカプセルの崩壊・懸濁性及び経管チューブの通過性に関する情報を教えてください。
本内容には承認を受けていない品質に関する情報が含まれています。試験方法等が確立していない内容も含まれており、あくまでも記載されている試験方法で得られた結果を事実として提示しています。医療従事者が臨床適用を検討する上での参考情報であり、加工等の可否を示すものではありません。
インタビューフォーム XIII.備考「1.調剤・服薬支援に際して臨床判断を行うにあたっての参考情報」に掲載しております。
以下のリンクから、ご参照ください。注:タブネオスカプセルの承認されている用法及び用量は、「通常、成人にはアバコパンとして1回30 mgを1日2回朝夕食後に経口投与する。」です。懸濁して投与する方法は、タブネオスカプセルの承認された用法及び用量ではありません。また、タブネオスカプセルを懸濁した製品での臨床試験、薬物動態、安定性、有効性及び安全性等のデータはなく、タブネオスカプセルの懸濁投与は推奨しません。
参考資料:
インタビューフォーム
〔2024年11月改訂〕





