サビーン点滴静注用 Q&A
「Q&A」は、医療関係者の皆様に向けて作成しています。
本内容は、製品の適正使用に関する参考情報であり、すべてのケースに当てはまるものではありません。また、国内で承認された効能効果・用法用量の範囲外の情報を含む場合がありますが、当社として推奨するものではありません。製品のご使用にあたっては、最新の電子添文をご確認ください。
「Q&A」のご利用によって、生じた結果につきましては、責任を負いかねますのでご了承ください。
※許可なく複写、複製、転掲、改変等を行うことはご遠慮ください。
-
Q1.サビーン点滴静注用の製品特性を教えてください。
1) 日本で初めて承認されたアントラサイクリン系抗悪性腫瘍剤の血管外漏出治療剤です。 2) アントラサイクリン系抗悪性腫瘍剤の血管外漏出によって引き起こされる組織障害を抑制します。 3) 海外臨床試験における副作用は80例中57例(71.3%)に認められました。主な副作用は、悪心(27.5%)、発熱(13.8%)、注射部位疼痛(13.8%)、嘔吐(12.5%)などでした。また、主な臨床検査値異常は、白血球数減少(72.5%)、好中球減少(60.8%)、ヘモグロビン減少(42.5%)、AST(GOT)上昇(27.6%)、血小板数減少(26.3%)、ALT(GPT)上昇(21.8%)、クレアチニン上昇(14.0%)、ビリルビン上昇(10.5%)などでした。
国内臨床試験2例における副作用は、悪心、発熱性好中球減少症、胸膜炎、倦怠感、貧血、肺炎、注入部位反応、紫斑、頭痛、白血球数減少、リンパ球数減少、血小板数減少、好中球数減少、アスパラギン酸アミノトランスフェラーゼ増加、血中尿素増加、血中クレアチニン増加でした(承認時)。
重大な副作用として骨髄抑制(白血球減少、好中球減少、血小板減少、ヘモグロビン減少)が報告されています。
詳細は、電子添文の副作用及び臨床成績の安全性の結果をご参照ください。参考資料:
インタビューフォーム
〔2025年2月作成〕-
Q2.サビーン点滴静注用の用法及び用量を教えてください。
サビーン点滴静注用の用法及び用量は、「通常、成人には、デクスラゾキサンとして、1日1回、投与1日目及び2日目は1000mg/m2(体表面積)、3日目は500mg/m2を1~2時間かけて3日間連続で静脈内投与する。なお、血管外漏出後6時間以内に可能な限り速やかに投与を開始し、投与2日目及び3日目は投与1日目と同時刻に投与を開始する。また、用量は、投与1日目及び2日目は各2000mg、3日目は1000mgを上限とする。中等度及び高度の腎機能障害のある患者(クレアチニンクリアランス:40mL/min未満)では投与量を通常の半量とする。」です。
サビーン点滴静注用の投与量は身長、体重より求めた体表面積より算出してください。<参考>
■サビーン調製投与ガイド■
サビーン情報サイトでは、サビーン点滴静注用の調製・投与の手順を動画で紹介しております。また、投与量早見表を作成しております。
以下のリンクから、ご参照ください。
参考資料:
電子添文
サビーン情報サイト
〔2025年2月作成〕-
Q3.サビーン点滴静注用は、血管外漏出後6時間以内に可能な限り速やかに投与を開始する理由を教えてください。
以下の理由により、「血管外漏出後6時間以内に可能な限り速やかに投与を開始する」と、設定されています。
① ダウノルビシン誘発皮膚潰瘍モデルマウスを用いた、デクスラゾキサンの投与タイミングの検討において、ダウノルビシン投与3時間後に、投与開始した場合に、潰瘍発現率の低下が認められました。また、ダウノルビシン投与6時間後に、投与開始した場合には、潰瘍発現率に影響は認められませんでしたが、潰瘍面積AUCは、対照群に比べて減少傾向(約34%)を示しました。
② 上記の非臨床試験結果等から、海外で承認取得のために実施された臨床試験において、血管外漏出後6時間以内に、サビーン点滴静注用の投与を開始した結果、有効性・安全性が確認されました。
③ 国内臨床試験の2例のいずれも、血管外漏出後6時間以内に、サビーン点滴静注用の投与が行なわれ、外科的処置は行われず、安全性も許容可能でした。
なお、サビーン点滴静注用は、海外で承認・販売されており、用法及び用量は確立されていること、国内外の有効性及び安全性プロファイルに違いがないと推測されたことから、海外と同一の用法及び用量となりました。
参考資料:
電子添文
インタビューフォーム
〔2025年2月改訂〕-
Q4.サビーン点滴静注用の2日目及び3日目の投与が1日目と同時刻に開始できない場合、どうしたらよいですか?
投与2日目及び3日目が投与1日目と同時刻に投与できなかった場合注)の有効性及び安全性に関するデータはありません。
<参考>
海外(EU、販売名:Savene)での用法及び用量(抜粋)は、「治療2日目と3日目は、1日目と同じ時間(±3時間)に開始すること。」となっています。注)サビーン点滴静注用の承認されている用法及び用量は、「通常、成人には、デクスラゾキサンとして、1日1回、投与1日目及び2日目は1000mg/m2(体表面積)、3日目は500mg/m2を1~2時間かけて3日間連続で静脈内投与する。なお、血管外漏出後6時間以内に可能な限り速やかに投与を開始し、投与2日目及び3日目は投与1日目と同時刻に投与を開始する。また、用量は投与1日目及び2日目は各2000mg、3日目は1000mgを上限とする。中等度及び高度の腎機能障害のある患者(クレアチニンクリアランス:40mL/min未満)では、投与量を通常の半量とする。」です。
参考資料:
インタビューフォーム
〔2025年2月作成〕-
Q5.サビーン点滴静注用の腎機能障害患者への投与に関する注意事項を教えてください。
中等度及び高度の腎機能障害のある患者(クレアチニンクリアランス(CCr):40mL/min未満)に対しては、通常の半量を投与してください。
腎機能障害患者には、血液毒性の発現に注意して観察してください。
デクスラゾキサンは大部分が腎排泄されることが知られており、腎機能障害のある患者では、デクスラゾキサンの排泄率が低下し、全身への曝露時間が延長する可能性があることから、副作用が強くあらわれるおそれがあります。<参考>
腎機能の程度が異なる24例の成人男性及び成人女性を対象として、150mg/m2注)のデクスラゾキサンを一定速度で15分間静脈注入したとき、デクスラゾキサンのCLtotは腎機能低下者で低下し、AUC0-∞は、腎機能正常者(CCr>80mL/min)と比べて、中等度(CCr:30~50mL/min)及び重度(CCr<30mL/min)の腎機能低下者では、2倍高値を示しました(外国人データ)。注)サビーン点滴静注用の承認されている用法及び用量は、「通常、成人には、デクスラゾキサンとして、1日1回、投与1日目及び2日目は1000mg/m2(体表面積)、3日目は500mg/m2を1~2時間かけて3日間連続で静脈内投与する。なお、血管外漏出後6 時間以内に可能な限り速やかに投与を開始し、投与2日目及び3日目は投与1日目と同時刻に投与を開始する。また、用量は投与1日目及び2日目は各2000mg、3日目は1000mgを上限とする。中等度及び高度の腎機能障害のある患者(クレアチニンクリアランス:40mL/min未満)では、投与量を通常の半量とする。」です。
参考資料:
電子添文
〔2025年2月改訂〕-
Q6.サビーン点滴静注用の肝機能障害患者への投与に関する注意事項を教えてください。
肝機能障害患者への投与は、肝機能障害の副作用がおこることがあるため、注意が必要です。
副作用としては、AST上昇、ALT上昇、総ビリルビン上昇、Al-P上昇、γ-GTP上昇が認められています。参考資料:
電子添文
〔2025年2月改訂〕-
Q7.サビーン点滴静注用の副作用を教えてください。
サビーン点滴静注用の重大な副作用は、骨髄抑制※(白血球減少、好中球減少、血小板減少、ヘモグロビン減少)(48.1%注))です。
※骨髄抑制については、「Q8. サビーン点滴静注用の重大な副作用「骨髄抑制」について教えてください。」をご参照ください。また、その他の副作用は、以下のとおりです。
これらの副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には、投与を中止するなど適切な処置を行ってください。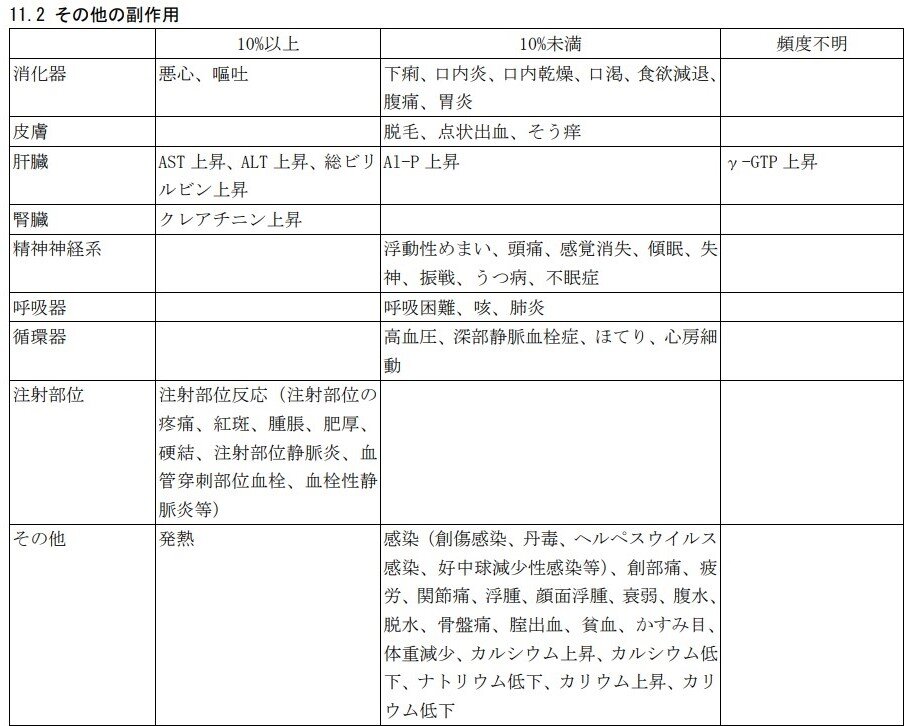
注) 使用成績調査(全例調査)の結果から算出
サビーン点滴静注用の国内臨床試験で認められた副作用は、以下のとおりです。
アントラサイクリン系抗悪性腫瘍剤の血管外漏出患者2例にサビーン点滴静注用を投与しました。1例目の被験者は腎機能低下が認められたため、投与量を通常の半量とし、1及び2日目は500mg/m2、3日目は250mg/m2を投与し、2例目の被験者は1及び2日目は1000mg/m2、3日目は500mg/m2を投与しました。
副作用として、1例目の被験者に悪心、血中尿素増加、血中クレアチニン増加、倦怠感、発熱性好中球減少症、胸膜炎、肺炎及び貧血、2例目の被験者に注入部位反応、アスパラギン酸アミノトランスフェラーゼ増加、リンパ球数減少、血小板数減少、好中球数減少、紫斑、頭痛、白血球数減少及び血中クレアチニン増加が認められました。
その他の臨床試験における副作用は、電子添文【17.臨床成績】をご参照ください。<参考>
■サビーン安全性情報■
サビーン情報サイトでは、サビーン点滴静注用の承認時および製造販売後の安全性情報を紹介しています。
以下のリンクから、ご参照ください。
参考資料:
電子添文
サビーン情報サイト
〔2025年2月改訂〕-
Q8.サビーン点滴静注用の重大な副作用「骨髄抑制」について教えてください。
サビーン点滴静注用の投与中に重篤な血球減少(白血球減少、好中球減少、血小板減少、ヘモグロビン減少)があらわれることがあり、投与後10日以上経過して発現する例が報告されています。また、骨髄抑制に起因する重篤な感染症(2.1%注))、発熱性好中球減少症(11.0%注))があらわれることがあります。
注)使用成績調査(全例調査)の結果から算出サビーン点滴静注用の投与中及び投与終了後は、定期的に血液検査を行うとともに患者の状態を十分観察し、異常が認められた場合には適切な処置を行ってください。
サビーン点滴静注用投与例で認められた骨髄抑制発現状況のアウトラインは、以下のリンクからご参照ください。
■骨髄抑制発現状況アウトライン■
参考資料:
電子添文
サビーン点滴静注用500mg骨髄抑制発現状況アウトライン
〔2025年2月作成〕-
Q9.サビーン点滴静注用が漏出した場合の対処方法を教えてください。
サビーン点滴静注用が血管外漏出した場合の特有な対処法はありません。
<参考>
海外の文献報告において、デクスラゾキサンは「Irritants(炎症性)」に分類されています1)。参考資料:
1)Firas Y Kreidieh et al.:World J Clin Oncol,7(1),87-97,2016.
〔2025年2月作成〕-
Q10.サビーン点滴静注用は、乳酸リンゲル液、日局生理食塩液又は5%ブドウ糖注射液で希釈することとなっていますが、一番適切な希釈液を教えてください。
血管痛を考慮して、希釈後の溶液のpHが高い乳酸リンゲル液を推奨しています。 海外第Ⅱ相臨床試験(TT01)、海外第Ⅱ/Ⅲ相臨床試験(TT02)の結果から、希釈後のpHの違いにより、注射部位局所の副作用(注射部位疼痛、注射部位静脈炎等) の発現割合が異なる可能性が示唆されています。
希釈液の違いによるpH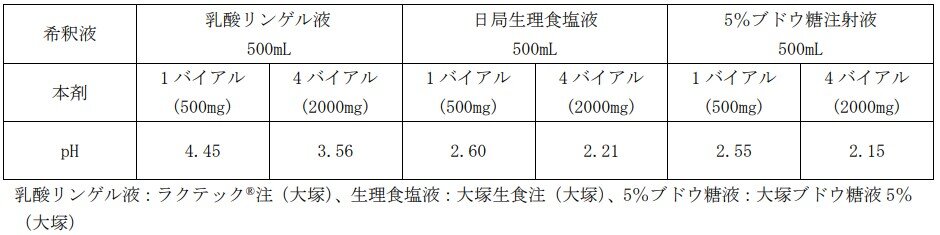
参考資料:
インタビューフォーム
新医薬品の「使用上の注意」の解説
〔2025年2月改訂〕-
Q11.サビーン点滴静注用は、調製後150分以内に投与を完了することになっている理由を教えてください。
配合変化試験の結果により、規定した品質を確保できる時間として設定しました。 乳酸リンゲル液との配合変化試験調製後180分において、類縁物質が規格不適合となったため、これを超えない時間として「150分以内に投与を完了すること」としています。調製した溶液は速やかに使用し、残液は廃棄してください。
※配合変化試験の結果は、「Q17. サビーン点滴静注用の輸液配合後の安定性を教えてください。」をご参照ください。参考資料:
電子添文
〔2025年2月改訂〕-
Q12.サビーン点滴静注用の調製は、安全キャビネット内で行う必要がありますか?
安全キャビネットの使用について、取り決めはありません。
デクスラゾキサンは遺伝毒性、がん原性、生殖発生毒性等の毒性を有するとされているため、抗がん剤に準じ取り扱うことも、ご考慮ください。
また、サビーン点滴静注用の調製時には、薬剤が皮膚・粘膜に付着しないように注意し、接触した場合には、直ちに水でよく洗い流してください。<参考>
英国の添付文書には、「溶解及び希釈は慎重に行い、細胞傷害性の薬剤を適切に扱うことができる標準的な手順を用いること。」と記載があります1)。参考資料:
電子添文
1)英国添付文書
〔2025年2月改訂〕-
Q13.サビーン点滴静注用の血中からの消失時間を教えてください。
デクスラゾキサンは、in vivo で速やかに(数分以内で)加水分解され、1つの環が開環した2種類の中間代謝物になります。中間代謝物Bの濃度は、デクスラゾキサン濃度の8~29%に達し、中間代謝物Cの濃度は同3~5%に達します。その後、これらの代謝物は、再び速やかに(15分で最高濃度に到達後、半減期2.5時間と0.6時間で消失)2つの環が開環したADR-925に変換され、その後、血清中から半減期24時間で消失しました(外国人データ)。
参考資料:
電子添文
〔2025年2月改訂〕-
Q14.サビーン点滴静注用の作用機序について教えてください。
- アントラサイクリン系抗悪性腫瘍剤が挿入(インターカレート)されたDNAは、トポイソメラーゼⅡと結合し(DNA-トポイソメラーゼ複合体の形成)、DNAが切断された状態で安定化します。その結果、トポイソメラーゼⅡによるDNAの再結合が阻害されて細胞毒性を発現し組織障害を誘発するものと考えられています(図1)。
デクスラゾキサンは、アントラサイクリン系抗悪性腫瘍剤の血管外漏出による組織障害に対し、トポイソメラーゼⅡの作用を阻害することにより組織障害抑制作用を示すとされ、主に以下の2つの作用機序が考えられています。
1)デクスラゾキサンは、トポイソメラーゼⅡと結合することによりATP結合部位の立体構造の変化を介してDNAのトポイソメラーゼⅡへの結合(DNA-トポイソメラーゼ複合体の形成)を阻害します(図2、作用機序1)。 2)デクスラゾキサンは、DNA-トポイソメラーゼ複合体に結合し、DNA切断前の状態で安定化させます。また、トポイソメラーゼⅡはタンパク質分解酵素により分解され減少します(図2、作用機序2)。 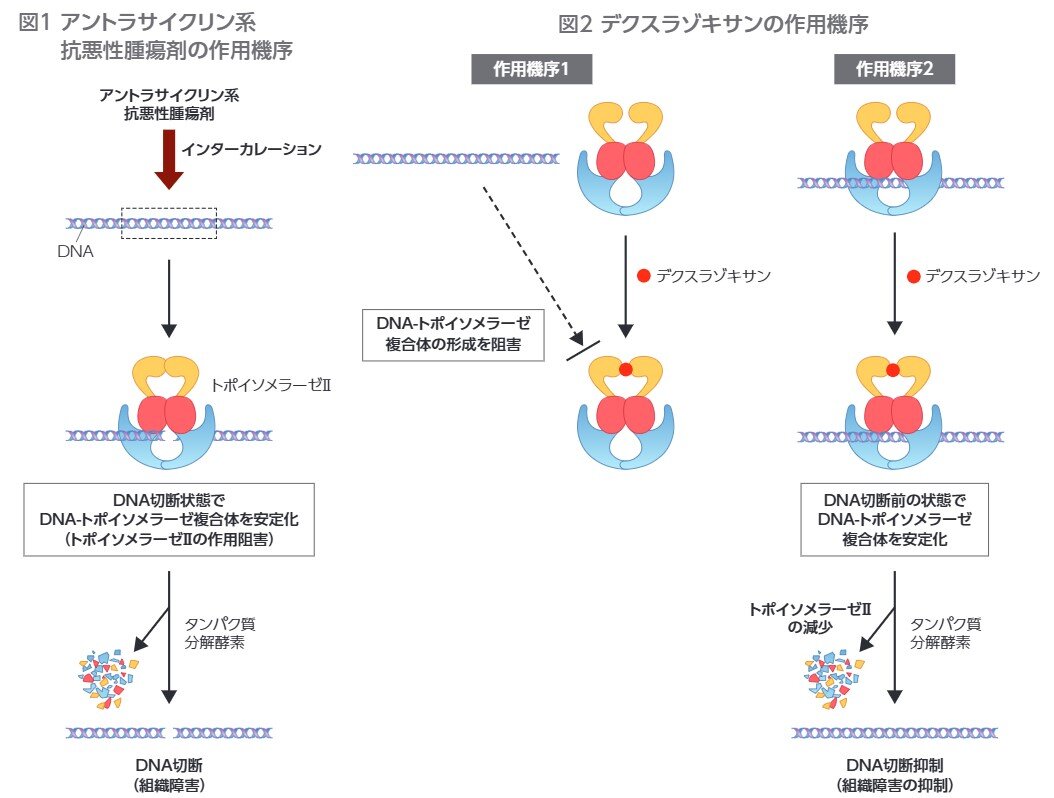
参考資料:
電子添文
インタビューフォーム
〔2025年2月作成〕 -
Q15.サビーン点滴静注用の投与によって、アントラサイクリン系抗悪性腫瘍剤の作用は、減弱しますか?
血管外漏出時に、サビーン点滴静注用を投与した際の、アントラサイクリン系抗悪性腫瘍剤の抗腫瘍効果に及ぼす影響について、検討した試験はありません。
しかし、デクスラゾキサンの作用機序※から、抗腫瘍効果を減弱させる可能性が考えられます。
※作用機序については、「Q14.サビーン点滴静注用の作用機序について教えてください。」をご参照ください。参考資料:
インタビューフォーム
〔2025年2月改訂〕-
Q16.サビーン点滴静注用の製剤の安定性を教えてください。
サビーン点滴静注用の安定性は、以下のとおりです。
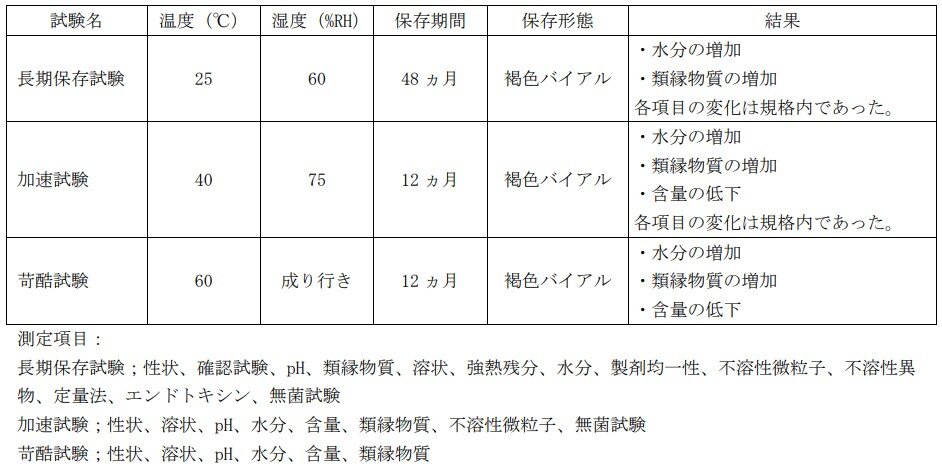
参考資料:
インタビューフォーム
〔2025年2月作成〕-
Q17.サビーン点滴静注用の輸液配合後の安定性を教えてください。
サビーン点滴静注用の輸液配合後の安定性は、以下のとおりです。
輸液配合後の安定性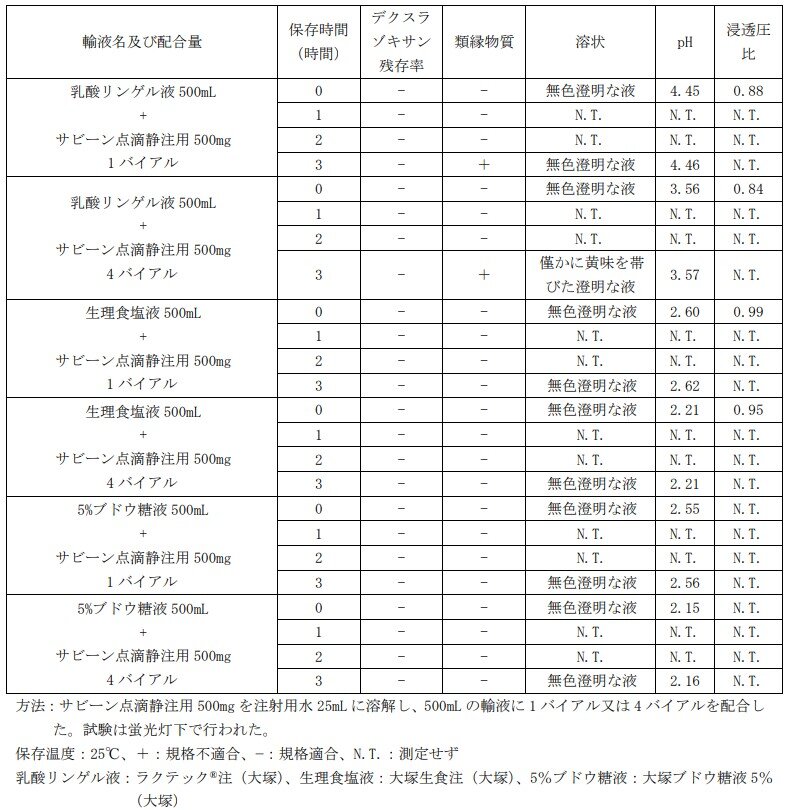
参考資料:
インタビューフォーム
〔2025年2月作成〕





