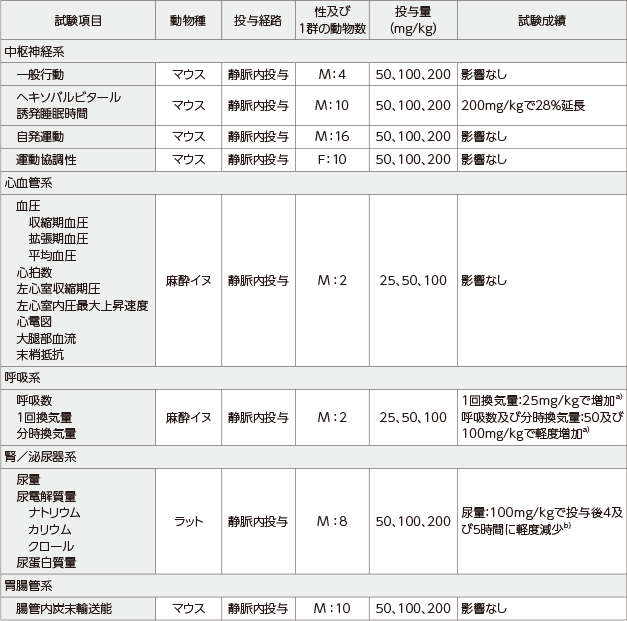
a) 用量依存性がみられず、媒体投与でも認められたことから、生物学的意義のないものと考えられた。
b) 用量依存性のない変化であり、デクスラゾキサンによる影響ではないと考えられた。
M:Male, F:Female
承認時申請資料:安全性薬理試験
■単回投与毒性試験24)
マウス及びラットにデクスラゾキサン600mg/kg(400及び200mg/kgの2分割)を静脈内投与した結果、概略の致死量はいずれも600mg/kg超と判断されました。
イヌにデクスラゾキサン50~2000mg/kgを単回静脈内投与した結果、2000mg/kgの雄1例が状態悪化により切迫屠殺されました。投与量の増加に従って骨髄、リンパ組織及び胃腸管粘膜への障害が認められました。
承認時評価資料:単回投与毒性試験
■反復投与毒性試験25)
ラットに5~200mg/kg/日を28日間又は1~25mg/kg/日を91日間反復静脈内投与した結果、脱毛、被毛粗剛、円背及び皮膚蒼白が観察され、体重増加抑制も認められました。血液学的検査では、赤血球数及び白血球数の低値が、血液生化学検査でASTの高値、尿検査でクレアチニン及び尿素の低値ならびに潜血反応が認められました。また、肝臓及び心臓重量の高値ならびに胸腺、脾臓、精巣及び精巣上体の小型化が認められ、造血器、リンパ系器官及び精巣の低形成、萎縮が認められました。これらの変化は、投与量との関連性が認められました。なお、これらの所見は回復性を示し、投与間隔の延長(2週間に1回)により減弱しました。
ウサギに50及び200mg/kg/日を反復静脈内投与した結果、投与22日目までに全例が死亡あるいは切迫屠殺され、精巣、脾臓、リンパ節及び胸腺の萎縮、骨髄の低形成、胃腸管の壊死が認められました。
イヌに15.625~125mg/kg/日を間歇静脈内投与(5日間の反復投与を3周期、各投与周期間に9日間の休薬期間を設けた)した結果、ラットと類似した毒性所見が認められました。
以上より、いずれの動物種においても低用量より毒性所見が認められ、無毒性量は得られませんでした。
承認時評価資料:反復投与毒性試験
■遺伝毒性試験26)
マウスを用いる小核試験において陽性であったことから、デクスラゾキサンは染色体異常誘発性を有すると判断されました。
細菌を用いる復帰突然変異試験注)は陰性であったが、マウスリンフォーマTK試験及びほ乳類培養細胞を用いる小核試験は陽性であったことから、本薬は遺伝毒性を有すると判断されました。
注)ラゾキサン(デクスラゾキサンとその鏡像異性体のラセミ体)の試験成績である。
承認時評価資料:遺伝毒性試験
■がん原性試験27)
マウスにラゾキサン※40及び80mg/kg/日を週3回52週間腹腔内投与した結果、雌マウスで造血系腫瘍(組織球性及びリンパ球性の悪性リンパ腫又はリンパ性白血病)が認められました。
ラットにラゾキサン※48及び96mg/kg/日を週3回52週間腹腔内投与した結果、雌ラットで子宮腺癌の発現頻度の増加が認められました。
以上より、デクスラゾキサンはがん原性を有すると判断されました。
※ラゾキサン:デクスラゾキサンとその鏡像異性体のラセミ体
National Toxicology Program: Natl Cancer Inst Carcinog Tech Rep Ser. 78,1. 1978
■生殖発生毒性試験1)
マウス、ラット及びウサギについて、ラゾキサン※の投与による胚・胎児死亡、発育遅延児又は形態異常児の報告があることから、デクスラゾキサンは催奇形性を含む生殖発生毒性を有すると考えられました。
※ラゾキサン:デクスラゾキサンとその鏡像異性体のラセミ体
Duke Dl:Teratology. 11, 119, 1974
■局所刺激性試験28)
ウサギの耳介静脈にデクスラゾキサンの3mg/mL溶液を0.5mL/分で1日30分間、3日間投与した結果、本薬は局所刺激性を有しないと判断されました。
承認時評価資料:局所刺激性試験
■その他の毒性試験29)
アントラサイクリン系抗悪性腫瘍剤であるドキソルビシン単独投与に対して、デクスラゾキサンとの併用をした時の毒性についてラットを用いて91日間の反復静脈内投与を行った結果、併用による毒性の増強は認められませんでした。
承認時評価資料:その他の毒性試験