ユリーフ錠 Q&A
「Q&A」は、医療関係者の皆様に向けて作成しています。
本内容は、製品の適正使用に関する参考情報であり、すべてのケースに当てはまるものではありません。また、国内で承認された効能効果・用法用量の範囲外の情報を含む場合がありますが、当社として推奨するものではありません。製品のご使用にあたっては、最新の電子添文をご確認ください。
「Q&A」のご利用によって、生じた結果につきましては、責任を負いかねますのでご了承ください。
※許可なく複写、複製、転掲、改変等を行うことはご遠慮ください。
-
Q1.ユリーフ錠の用法は食後投与ですが、食事の影響はありますか?
ユリーフ錠で検討したデータはありませんが、ユリーフカプセル(販売中止)の承認時の第Ⅰ相臨床試験において、健康成人男性11例にシロドシン4mg(カプセル)を食後30分及び空腹時に単回経口投与したとき注)、食後投与及び空腹時投与でそれぞれ、Cmaxは23.0及び28.0ng/mL、AUC0-48hrは128.8及び135.9ng・hr/mL、Tmaxは2.1及び1.4時間、t1/2は6.0及び4.7時間でした。
健康成人男性における4mg投与時の薬物動態パラメータ
注)ユリーフ錠の承認されている用法及び用量は、「1回4mgを1日2回朝夕食後に経口投与する。なお、症状に応じて適宜減量する。」です。
参考資料:
電子添文
〔2025年3月改訂〕-
Q2.ユリーフ錠の腎機能障害患者への投与に関する注意事項を教えてください。
腎機能障害患者では、シロドシンの血漿中濃度が上昇するため、患者の状態を観察しながら低用量(1回2mg)から投与を開始するなどを考慮してください。
ユリーフ錠で検討したデータはありませんが、腎機能低下者(クレアチニンクリアランス27~49mL/min)6例及び腎機能正常者(クレアチニンクリアランス125~176mL/min)7例にシロドシン4mg(カプセル:販売中止)を単回経口投与したとき注)、腎機能低下者では腎機能正常者に比べて、シロドシンの血漿中総薬物濃度の上昇がみられました(Cmax3.1倍、AUC0-∞3.2倍)。この血漿中総薬物濃度の上昇は血清中α1-酸性糖タンパクとのタンパク結合による可能性があり、血漿中総薬物濃度と血清中α1-酸性糖タンパク濃度の間には高い相関が認められました。
なお、シロドシンの薬効及び副作用発現に直接関与すると考えられる血漿中非結合形シロドシン濃度の上昇は、総薬物濃度より小さいものでした(Cmax1.5倍、AUC0-∞2.0倍)。腎機能低下者及び腎機能正常者に空腹時4mg単回投与時の薬物動態パラメータ
注)ユリーフ錠の承認されている用法及び用量は、「1回4mgを1日2回朝夕食後に経口投与する。なお、症状に応じて適宜減量する。」です。
腎機能障害のある患者での使用経験は少ないものの、血漿中薬物濃度が上昇することが示されていることから、ユリーフ錠を投与する際は、低用量から開始するなど慎重に投与する必要があります。
参考資料:
電子添文
インタビューフォーム
〔2025年3月改訂〕-
Q3.ユリーフ錠の肝機能障害患者への投与に関する注意事項を教えてください。
肝機能障害患者では、シロドシンの血漿中濃度が上昇するおそれがあるため、患者の状態を観察しながら低用量(1回2mg)から投与を開始するなどを考慮してください。
ユリーフ錠で検討したデータはありませんが、ユリーフカプセル(販売中止)の長期投与試験における母集団薬物動態解析で、肝機能の指標であるALT(GPT)の上昇により、シロドシンのクリアランス及び分布容積が低下し、血漿中薬物濃度が上昇する可能性が示されました。
なお、母集団薬物動態解析で肝機能低下のクリアランスへの影響を検討した結果、ALT(GPT)が23から83IU/Lに上昇した場合、投与2時間後(Cmax付近)の血漿中薬物濃度は肝機能が正常な場合に比べ1.7倍(26.6→45.2ng/mL)に上昇する可能性が示唆されました。
シロドシンが肝代謝型薬剤であることから、肝機能障害患者では、血漿中薬物濃度上昇の可能性があり、ユリーフ錠を投与する際は低用量から開始するなど慎重に投与する必要があります。参考資料:
電子添文
インタビューフォーム
〔2025年3月改訂〕-
Q4.ユリーフ錠と併用注意の薬剤を教えてください。
シロドシンは、主としてチトクロームP450 3A4(CYP3A4)により代謝されます。
以下の薬剤との併用に注意してください。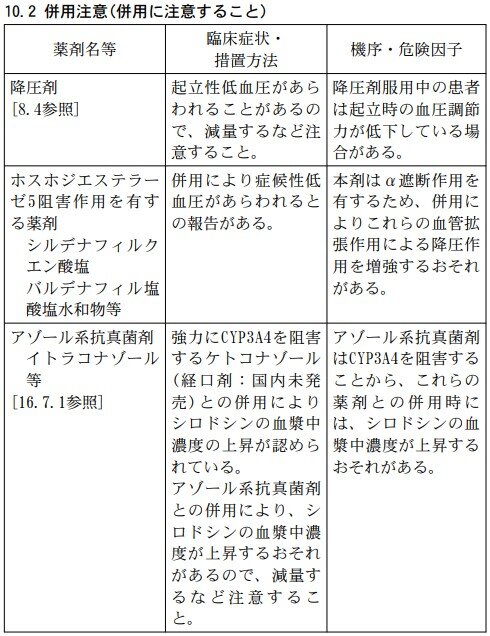
参考資料:
電子添文
〔2025年3月作成〕-
Q5.ユリーフ錠の副作用を教えてください。
ユリーフ錠の重大な副作用は、失神・意識喪失、肝機能障害、黄疸(いずれも頻度不明)です。
また、その他の副作用は、以下のとおりです。
これらの副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には、投与を中止するなど適切な処置を行ってください。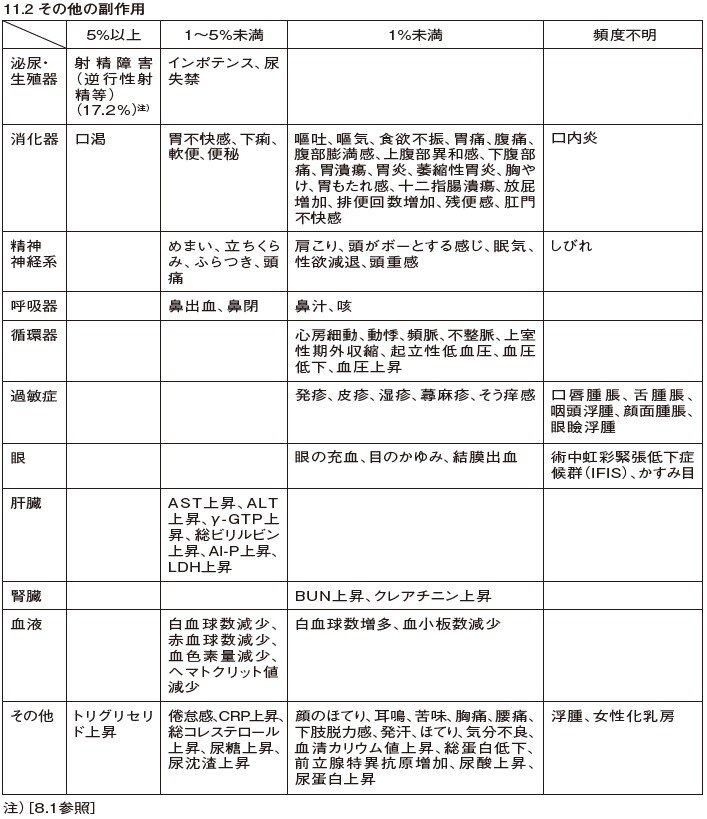
ユリーフ錠ではありませんが、ユリーフカプセル(販売中止)の臨床試験で認められた副作用は、以下のとおりです。
〇国内第Ⅲ相二重盲検比較試験
前立腺肥大症に伴う排尿障害患者を対象に、ユリーフカプセル1回4mg1日2回又はプラセボを12週間経口投与しました。
副作用発現割合は、ユリーフカプセル群54.9%(96/175例)、プラセボ群22.5%(20/89例)でした。ユリーフカプセル群の主な副作用は、射精障害22.3% (39/175例)、軟便及び口渇各8.6%(15/175例)、尿失禁5.7%(10/175例)、下痢4.6%(8/175例)、鼻閉4.0%(7/175例)でした。
副作用(臨床検査値)発現割合は、ユリーフカプセル群31.4%(55/175例)、プラセボ群 21.6%(19/88例)でした。ユリーフカプセル群の主な副作用(臨床検査値)は、トリグリセリド上昇12.0%(21/175例)、CRP上昇5.7%(10/175例)、γ-GTP上昇3.4%(6/175例)でした。〇国内長期投与試験
前立腺肥大症に伴う排尿障害患者364例を対象に、ユリーフカプセル1回4mg1日2回を52週間経口投与しました。
副作用発現割合は、65.4%(238/364例)でした。主な副作用は、射精障害25.0%(91/364例)、下痢7.4%(27/364例)、口渇7.1%(26/364例)、立ちくらみ6.6%(24/364例)、鼻閉5.8%(21/364例)、ふらつき(感)5.2%(19/364例)でした。
副作用(臨床検査値)発現割合は、31.1%(112/360例)でした。主な副作用(臨床検査値)は、トリグリセリド上昇9.2%(33/359例)、ALT上昇4.2%(15/360例)、白血球数減少3.9% (14/358例)、ヘモグロビン量減少3.6%(13/357例)、ヘマトクリット値減少3.6%(13/357例)、AST上昇3.6%(13/360例)、赤血球数減少3.4%(12/358例)及びCRP上昇3.1%(11/359例)でした。その他の臨床試験における副作用は、電子添文【17.臨床成績】をご参照ください。
参考資料:
電子添文
〔2025年3月作成〕-
Q6.ユリーフ錠の副作用「射精障害」について教えてください。
射精障害とは精管、精嚢、膀胱頸部(膀胱出口)の収縮が抑えられるため、射精時の精液量が減少したり出なくなる現象です。
ユリーフ錠による射精障害は、以下の機序が考えられます。
● α1受容体(特にα1A受容体)遮断に基づく下部尿路組織平滑筋の弛緩により、射精時の膀胱頸部(内尿道口)の閉鎖不全が生じ、精液が膀胱内に逆流してしまう「逆行性射精」。 ● α1受容体(特にα1A受容体)は精嚢や精管にも豊富に分布していることから、その遮断により、精嚢・精管内圧の低下、収縮の抑制が生じ、後部尿道に精液が出てこない「射出障害」。
ユリーフ錠による射精障害は、勃起不全(ED)などに比べ、性生活には問題は少ないと考えられます。しかし、患者の年齢や状況によって受け取り方は異なり、特に性的活動期の患者においては問題となる可能性もあることから、ユリーフ錠投与前に射精障害について患者に十分に説明を行い、リスクとベネフィットを考慮し、射精障害を許容できる患者に投与してください。
参考資料:
インタビューフォーム
新医薬品の「使用上の注意」の解説
〔2025年3月改訂〕-
Q7.ユリーフ錠の副作用「射精障害」は、回復しますか?
ユリーフ錠で検討したデータはありませんが、ユリーフカプセル(販売中止)承認時の国内臨床試験において、射精障害発現例150例155件のうち、その後射精の機会がなかったなどの理由により転帰が確認できなかった症例を除き、145件で症状の消失が確認されています。
射精障害消失確認時期(ユリーフカプセルの投与中止または投与終了から消失確認までの日数)は、患者の性行為等の機会で左右されることから、正確な時期ではありませんが、23件がユリーフカプセル投与継続中に、3件は減量後に消失が確認されています。
なお、ユリーフカプセル投与継続中の消失を含めた約8割で投与終了後4週以内に消失が確認されました。ユリーフ錠の使用にあたっては、ユリーフ錠のリスクを十分に検討の上、患者に対しては副作用の説明を十分に行った上でご使用ください。
参考資料:
電子添文
新医薬品の「使用上の注意」の解説
〔2025年3月改訂〕-
Q8.ユリーフ錠の副作用「口渇、鼻閉、下痢、軟便」の発現機序を教えてください。
口渇及び鼻閉については、唾液腺や鼻粘膜の血管にもα1Aアドレナリン受容体サブタイプの発現が推定されることから、シロドシンがα1Aアドレナリン受容体サブタイプを遮断することにより発現したものと考えられます。
下痢及び軟便については、シロドシンの毒性試験でも確認されており、動物及びヒトに共通の症状でした。また、ラットの消化管においてはα1Aアドレナリン受容体サブタイプの発現が認められることから、下痢及び軟便は、シロドシンが交感神経支配を抑制したことに起因して発現した可能性が考えられます。
参考資料:
ユリーフカプセル 審査報告書
〔2025年3月改訂〕-
Q9.ユリーフ錠の副作用「術中虹彩緊張低下症候群(IFIS)」について教えてください。
IFIS(Intraoperative Floppy Iris Syndrome)とは、縮瞳型症候群の一種で、術中の洗浄液流による虹彩の弛緩と膨張、術中の進行性の縮瞳、虹彩が水晶体乳化術の切開部への脱出の3症状の併発が特徴とされています。
白内障手術などの眼科手術では、手術を行いやすくするために虹彩を収縮させて散瞳状態にします。IFISは、手術中に収縮させていた虹彩が突然弛緩・膨張してしまう症状です。
α1遮断薬を服用中又は過去に服用経験のある患者において、α1遮断作用によると考えられるIFISがあらわれるとの報告があります。
参考資料:
電子添文
インタビューフォーム
新医薬品の「使用上の注意」の解説
〔2025年3月改訂〕-
Q10.ユリーフ錠の副作用「術中虹彩緊張低下症候群(IFIS)」は、予防できますか?
ユリーフ錠の投与に伴うIFIS(Intraoperative Floppy Iris Syndrome )の予防法は、手術前の休薬も含め確立したものはありません。
α1遮断薬を服用中又は過去に服用経験のある患者において、α1遮断作用によると考えられるIFISがあらわれるとの報告があります1)。
なお、手術中にIFISの対策を行うためには、事前に服薬歴を確認し、薬剤や医療器具を準備しておくことが重要です2)。ユリーフ錠の服用経験があり、白内障手術等の眼内手術を予定している患者に対しては、あらかじめユリーフ錠の服薬状況について眼科医師に伝えるようご指導をお願いします3)。
参考資料:
1)電子添文
2)黒坂大次郎:眼科,54(1),21-25,2012.
3)新医薬品の「使用上の注意」の解説
〔2025年3月改訂〕-
Q11.ユリーフ錠とユリーフOD錠で有効性や安全性に違いはありますか?
生物学的同等性試験の結果、ユリーフ錠とユリーフOD錠は、生物学的同等性が確認されているため、有効性や安全性は同等であると考えられます。
シロドシン4mgOD錠(水なし又は水で服用)と シロドシン4mg錠(標準製剤、水で服用)を、クロスオーバー法によりそれぞれを1錠(シロトドシンとして4mg)健康成人男性に絶食単回経口投与して注)、血漿中シロドシン濃度を測定して得られた薬物動態パラメータ(AUC0-48hr、Cmax)について、90%信頼区間法にて統計解析を行った結果、log(0.8)〜log(1.25)の範囲内であり、両剤の生物学的同等性が確認されました。
注)ユリーフ錠・ユリーフOD錠の承認されている用法及び用量は、「1回4mgを1日2回朝夕食後に経口投与する。なお、症状に応じて適宜減量する。」です。
参考資料:
電子添文
〔2025年3月改訂〕-
Q12.ユリーフ錠の作用機序について教えてください。
シロドシンは、下部尿路組織である前立腺、尿道及び膀胱三角部に分布するα1A-アドレナリン受容体サブタイプを介する交感神経系を遮断することにより、下部尿路組織平滑筋の緊張を緩和し、尿道内圧の上昇を抑制し、前立腺肥大症に伴う排尿障害を改善します。
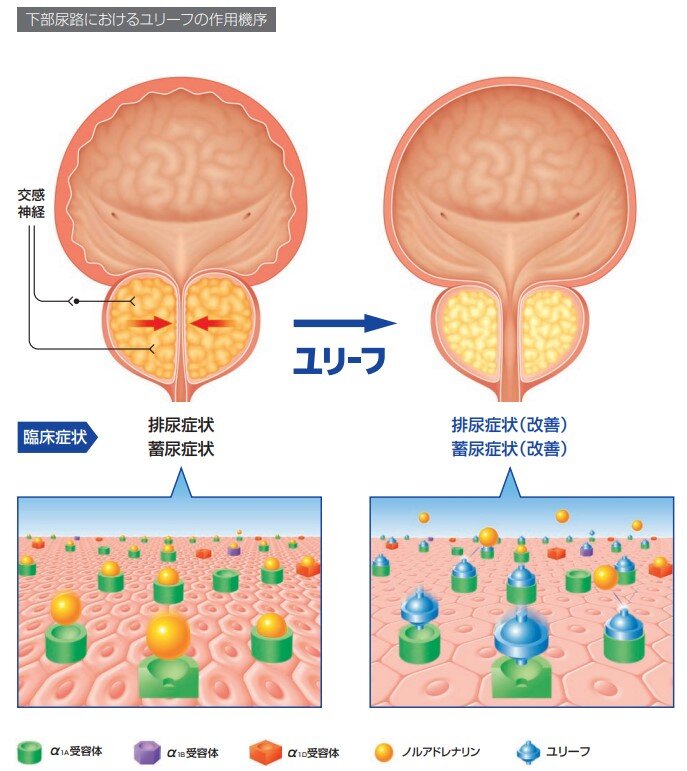
参考資料:
電子添文
インタビューフォーム
〔2025年3月作成〕-
Q13.キッセイ薬品と第一三共の製品は、錠剤やPTPの外観は同じですか?
ユリーフ錠2mg、4mgともに、錠剤の外観は同じです。
色調、外形、大きさ、識別コードも同じです。PTPシートに違いがあります。
キッセイ薬品製品には、ブランドマークがありませんが、第一三共製品には、PTPシート(錠剤が見えている側)に「第一三共のブランドマーク」が印刷されています。PTP裏面に印字されたバーコード(GS1-RSSコード)は両社で異なります。
参考資料:
電子添文
〔2025年3月改訂〕-
Q14.ユリーフ錠の製剤の安定性を教えてください。
ユリーフ錠の安定性は、以下のとおりです。
ユリーフ錠 2mg、4mg の各種条件下における安定性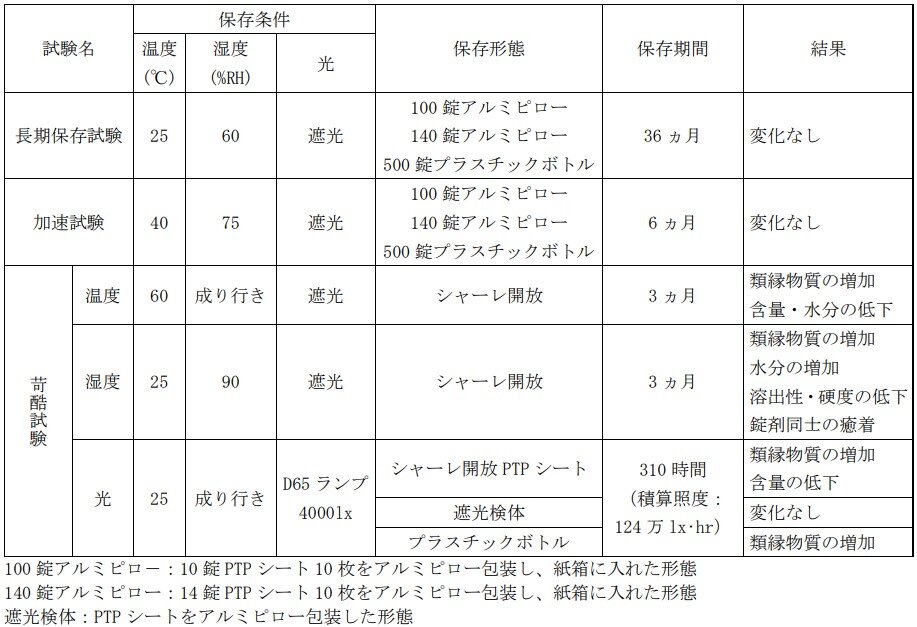
参考資料:
インタビューフォーム
〔2025年3月作成〕-
Q15.ユリーフ錠の粉砕、崩壊・懸濁性及び経管チューブの通過性に関する情報を教えてください。
本内容には承認を受けていない品質に関する情報が含まれています。試験方法等が確立していない内容も含まれており、あくまでも記載されている試験方法で得られた結果を事実として提示しています。医療従事者が臨床適用を検討する上での参考情報であり、加工等の可否を示すものではありません。 インタビューフォーム XIII.備考「1.調剤・服薬支援に際して臨床判断を行うにあたっての参考情報」に掲載しております。
以下のリンクから、ご参照ください。■粉砕品の安定性■
■崩壊・懸濁性及び経管チューブの通過性■注:ユリーフ錠の承認されている用法及び用量は、「1回4mgを1日2回朝夕食後に経口投与する。なお、症状に応じて適宜減量する。」です。粉砕又は懸濁して投与する方法は、ユリーフ錠の承認された用法及び用量ではありません。また、ユリーフ錠を粉砕又は懸濁した製品での臨床試験、薬物動態、安定性、有効性及び安全性等のデータはなく、ユリーフ錠の粉砕投与及び懸濁投与は推奨しません。
参考資料:
インタビューフォーム
〔2025年3月改訂〕




