タバリス錠 Q&A
「Q&A」は、医療関係者の皆様に向けて作成しています。
本内容は、製品の適正使用に関する参考情報であり、すべてのケースに当てはまるものではありません。また、国内で承認された効能効果・用法用量の範囲外の情報を含む場合がありますが、当社として推奨するものではありません。製品のご使用にあたっては、最新の電子添文をご確認ください。
「Q&A」のご利用によって、生じた結果につきましては、責任を負いかねますのでご了承ください。
※許可なく複写、複製、転掲、改変等を行うことはご遠慮ください。
-
Q1.タバリス錠の製品特性を教えてください。
1) 脾臓チロシンキナーゼを阻害することで、マクロファージによる血小板の破壊を抑制します。 ・ 血小板の破壊が亢進することにより血小板減少を来すことが、特発性血小板減少性紫斑病(ITP)の主な病態と考えられています。 ・ ホスタマチニブは、生体内で活性本体であるR406に代謝されます。 ・ R406は、Fcγ受容体シグナルの活性化に重要な調節因子である脾臓チロシンキナーゼを阻害します。その結果、抗血小板自己抗体が結合した血小板のマクロファージによる貪食及び破壊を抑制します。 2) 国内第Ⅲ相臨床試験(R788-1301試験)において、主要評価項目であるStable platelet responseを達成した患者割合はプラセボと比較して高く(タバリス錠群:36.4%、プラセボ群:0.0%)、有意差(p=0.030:Fisher's Exact検定)が認められました。
Stable platelet responseは、投与14~24週までの6回の来院のうち、レスキュー治療を行わずに、4回以上で血小板数が50,000/μL以上を達成した患者を、レスポンダーと定義しました。3) 食事の有無に関係なく、服用可能な経口剤です。 4) 以下の場合で、診療ガイドライン等の最新の情報を参考に、タバリス錠の投与が適切と判断される患者に投与をしてください。 ・ 他の治療にて十分な効果が得られない場合、又は忍容性に問題があると考えられる場合 ・ 血小板数、臨床症状からみて出血リスクが高いと考えられる場合 5) 重大な副作用として、重度の下痢、高血圧、好中球減少、感染症、肝機能障害があらわれることがあります。
主な副作用(発現割合10%以上)として、下痢、悪心が報告されています。
詳細は、電子化された添付文書の副作用及び各臨床成績の安全性の結果をご参照ください。参考資料:
インタビューフォーム
〔2024年6月改訂〕-
Q2.タバリス錠の用法及び用量、用量の調節方法を教えてください。
タバリス錠の用法及び用量は、「通常、成人には、ホスタマチニブとして初回投与量100mgを1日2回、経口投与する。初回投与量を4週間以上投与しても目標とする血小板数の増加が認められず、安全性に問題がない場合は150mgを1日2回に増量する。なお、血小板数、症状に応じて適宜増減するが、最高投与量は1回150mgを1日2回とする。」です。
タバリス錠の投与中は、血液学的検査、肝機能検査及び血圧測定を定期的に実施し、血小板数及び症状に応じてタバリス錠の用量を調節してください。
用量調節にあたっては、下図を参考に、適宜1段階ずつ増減してください。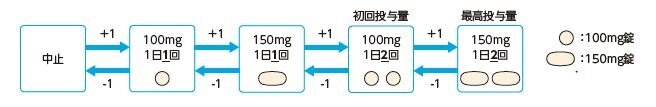
・ 100mg/日未満への減量が必要な場合は、投与を中止してください。 ・ タバリス錠は、食事の有無に関わらず服用できますが、1日2回投与では8時間を目安に、間隔を空けて投与してください。 ・ 治療上必要最小限の用量で使用してください。
タバリス錠は医療従事者向けRMP資材を作成しております。
■用法・用量■
以下のリンクから、ご参照ください。
参考資料:
電子添文
【医療従事者向けRMP資材】タバリス錠100mg・150mg投与における注意事項
〔2025年1月改訂〕-
Q3.タバリス錠は食事の影響はありますか?
健康被験者28例を対象に、タバリス錠150mgを食後(高脂肪/高カロリー食)に単回経口投与したとき注)、空腹時と比べて活性本体であるR406のAUC0-∞及びCmaxは、それぞれ1.23倍及び1.15倍でした(外国人データ)。
注)タバリス錠の承認されている用法及び用量は、「通常、成人には、ホスタマチニブとして初回投与量100mgを1日2回、経口投与する。初回投与量を4週間以上投与しても目標とする血小板数の増加が認められず、安全性に問題がない場合は150mgを1日2回に増量する。なお、血小板数、症状に応じて適宜増減するが、最高投与量は1回150mgを1日2回とする。」です。
参考資料:
電子添文
〔2024年6月改訂〕-
Q4.タバリス錠を飲み忘れた場合、どうすればよいですか?
飲み忘れに気づいた場合には、その回の服用はせずに、次の服用時間に1回分を服用してください。2回分を一度に服用しないでください。
タバリス錠は患者さん向けRMP資材を作成しております。
■タバリス錠の服用方法■
以下のリンクから、ご参照ください。
参考資料
【患者さん向けRMP資材】タバリス錠による治療を受ける方へ
〔2025年1月改訂〕-
Q5.タバリス錠の血栓症又は血栓塞栓症の既往歴(動脈及び静脈血栓塞栓症など)や素因(第V因子ライデン変異、アンチトロンビンⅢ欠損症など)を有する患者への投与に関する注意事項を教えてください。
血栓塞栓症があらわれるおそれがあるため、患者の状態を観察しながら慎重に投与してください。血栓症又は血栓塞栓症の既往歴や、素因を有する患者を対象とした臨床試験は実施していません。
タバリス錠は医療従事者向けRMP資材を作成しております。
■投与対象患者の選択 3. 注意が必要な患者■
以下のリンクから、ご参照ください。
参考資料:
電子添文
【医療従事者向けRMP資材】タバリス錠100mg・150mg投与における注意事項
〔2025年1月改訂〕-
Q6.タバリス錠のB型肝炎ウイルスキャリアの患者又は、既往感染者(HBs抗原陰性、かつHBc抗体又はHBs抗体陽性)への投与に関する注意事項を教えてください。
国内第Ⅲ相臨床試験に登録されたB型肝炎ウイルスキャリアの患者又は、既往感染者において、肝炎等のB型肝炎ウイルスの再活性化を疑う有害事象の発現は認められていません。
しかし、タバリス錠の作用機序等からB型肝炎ウイルス再活性化のリスクを、完全には否定できないため、患者の臨床症状と臨床検査値の観察を十分に行い、B型肝炎再燃の徴候に注意して投与してください。
タバリス錠は医療従事者向けRMP資材を作成しております。
■投与対象患者の選択 3. 注意が必要な患者■
以下のリンクから、ご参照ください。
参考資料:
電子添文
【医療従事者向けRMP資材】タバリス錠100mg・150mg投与における注意事項
〔2025年1月改訂〕-
Q7.タバリス錠の腎機能障害患者への投与に関する注意事項を教えてください。
腎機能障害患者に対し、電子添文『9.特定の背景を有する患者に関する注意』の項にて、注意喚起はしていません。
腎機能障害患者を対象に、タバリス錠150mgを空腹時に単回経口投与したとき注)、腎機能正常者8例と比べて、活性本体であるR406のAUC0-∞及びCmaxは、中等度の腎機能障害患者8例(Ccr:30以上50mL/min未満)で、それぞれ0.78倍及び0.58倍、血液透析を要する末期腎不全患者8例(透析後投与)で、それぞれ0.74倍及び0.62倍でした。また、末期腎不全患者に、タバリス錠150 mgを透析開始2時間前に単回経口投与したとき注)、透析により除去されたR406量は、投与量の1%未満でした。非結合形R406のAUC0-∞及びCmaxは、腎機能障害患者と腎機能正常者とで同程度でした(外国人データ)。
注)タバリス錠の承認されている用法及び用量は、「通常、成人には、ホスタマチニブとして初回投与量100mgを1日2回、経口投与する。初回投与量を4週間以上投与しても目標とする血小板数の増加が認められず、安全性に問題がない場合は150mgを1日2回に増量する。なお、血小板数、症状に応じて適宜増減するが、最高投与量は1回150mgを1日2回とする。」です。
参考資料:
電子添文
〔2024年6月改訂〕-
Q8.タバリス錠の肝機能障害患者への投与に関する注意事項を教えてください。
重度の肝機能障害患者(Child-Pugh分類C)では、タバリス錠投与の可否を慎重に判断し、投与する場合には初回投与量の減量を考慮するとともに、患者の状態を十分に観察しながら慎重に投与してください。非結合形R406の血中濃度が上昇するおそれがあります。
肝機能障害患者を対象にタバリス錠150mgを空腹時に単回経口投与したとき注)、肝機能正常者8例と比べて、活性本体であるR406のAUC0-∞及びCmaxは、軽度の肝機能障害患者8例(Child-Pugh分類A)で、それぞれ0.71倍及び0.89倍、中等度の肝機能障害患者8例(Child-Pugh分類B)で、それぞれ0.76倍及び0.87倍、重度の肝機能障害患者8例(Child-Pugh分類C)で、それぞれ1.06倍及び0.84倍でした。重度の肝機能障害患者における非結合形R406のAUC0-∞及びCmaxは、肝機能正常者と比べて、それぞれ1.7倍及び1.3倍でした(外国人データ)。
注)タバリス錠の承認されている用法及び用量は、「通常、成人には、ホスタマチニブとして初回投与量100mgを1日2回、経口投与する。初回投与量を4週間以上投与しても目標とする血小板数の増加が認められず、安全性に問題がない場合は150mgを1日2回に増量する。なお、血小板数、症状に応じて適宜増減するが、最高投与量は1回150mgを1日2回とする。」です。
参考資料:
電子添文
〔2024年6月改訂〕-
Q9.タバリス錠の生殖能を有する者への投与に関する注意事項を教えてください。
タバリス錠投与中及び最終投与後一定期間は、適切な避妊を徹底するように指導してください。
ヒトの受胎能への影響に関するデータは得られていませんが、動物実験(雌ラット)において受胎率の低下が報告されていることから、タバリス錠は女性の受胎能に影響を及ぼす可能性があります。
ヒトにおける活性本体であるR406の血中半減期から、投与終了後約3日でR406は血中からほぼ消失すると推定されますが、動物実験の結果を踏まえて、妊娠可能な女性においては、投与中及び最終投与後1ヵ月以上は、適切な避妊を徹底するように指導してください。<参考>
[受胎能及び初期胚発生に関する試験(ラット)]・ 25mg/kg/日を投与された雌動物で、受胎率の低下及び着床後胚死亡率の増加が認められました。 ・ 雄動物では、生殖機能への影響は認められませんでした。
タバリス錠は医療従事者向けRMP資材を作成しております。
■投与対象患者の選択 3. 注意が必要な患者■
以下のリンクから、ご参照ください。
参考資料:
電子添文
【医療従事者向けRMP資材】タバリス錠100mg・150mg投与における注意事項
〔2025年1月改訂〕-
Q10.タバリス錠は妊婦に投与してもよいですか?
妊婦又は妊娠している可能性のある女性には、投与しないでください。また、投与中に妊娠が判明した場合には、直ちに投与を中止してください。
海外の臨床試験において、妊娠した患者で死産/自然流産の報告があります。
動物実験(ラット及びウサギ)において、臨床推奨用量を下回る曝露で胚・胎児死亡率の増加、胎児の低体重並びに骨格及び内臓異常(変異及び奇形)が認められております。<参考>
■臨床試験
[関節リウマチ(RA)患者を対象とした海外臨床試験注)]・ 14例の妊娠例が報告されており、転帰は健康な新生児の出産3例、早産1例、死産1例、自然流産3例、並びに人工妊娠中絶6例でした。
[特発性血小板減少性紫斑病(ITP)患者を対象とした海外臨床試験] ・ 1例の妊娠例が報告されており、転帰は自然流産でした。
■非臨床試験
[受胎能及び初期胚発生に関する試験(ラット)]・ 25mg/kg/日を投与された雌動物で、受胎率の低下及び着床後胚死亡率の増加が認められました。
[胚・胎児発生に関する試験(ラット及びウサギ)] ・ 12.5mg/kg/日以上(ラット)又は22mg/kg/日以上(ウサギ)を投与された母動物で、着床後胚死亡の増加、胎児体重の低下並びに胎児の変異及び奇形が認められました。
注)タバリス錠の承認されている効能又は効果は、「慢性特発性血小板減少性紫斑病」です。
参考資料:
電子添文
インタビューフォーム
〔2024年6月改訂〕-
Q11.タバリス錠は授乳婦に投与してもよいですか?
授乳を行わないように指導してください。
動物実験において、乳汁移行及び出生児死亡率の増加等が認められており、乳汁を介した曝露に起因する重篤な副作用が乳児に起こる可能性があります。
ヒトにおける活性本体であるR406の血中半減期から、投与終了後約3日でR406は血中からほぼ消失すると考えられ、乳汁中に残留するR406も同程度の期間で消失すると推定されます。しかし、乳汁移行に伴うリスクを十分に踏まえて、投与中及び最終投与後1ヵ月以上は授乳を行わないよう、ご指導ください。<参考>
[動物実験(ラット)]・ R406の乳汁移行が認められ、乳汁/血漿中濃度比は5.5~9.9倍でした。
[出生前及び出生後の発生並びに母体の機能に関する試験(ラット)] ・ 12.5mg/kg/日以上を投与された母動物で、離乳までの期間における出生児死亡率の増加及び離乳後の期間を通じた出生児の低体重が認められました。
タバリス錠は医療従事者向けRMP資材を作成しております。
■投与対象患者の選択 3. 注意が必要な患者■
以下のリンクから、ご参照ください。
参考資料:
電子添文
【医療従事者向けRMP資材】タバリス錠100mg・150mg投与における注意事項
〔2025年1月改訂〕-
Q12.タバリス錠は小児に投与してもよいですか?
18歳未満の患者への投与は推奨されません。小児を対象とした臨床試験は実施しておらず、国内及び海外臨床試験で18歳未満への投与経験はないためです。
動物実験(ラット、マウス及び幼若ウサギ)において、活発に成長している骨への影響として、大腿骨頭の軟骨形成異常、大腿骨近位及び大腿脛骨関節の成長板異形成、並びに大腿骨及び胸骨の骨髄細胞密度の減少が認められました。<参考>
[反復投与毒性試験又はがん原性試験(ラット及びマウス)]・ 大腿骨頭部の軟骨形成異常等が認められました。
[新生児を用いた試験(幼若ウサギ)] ・ 大腿骨近位部及び大腿脛骨関節部に成長板の異形成等が認められました。
タバリス錠は医療従事者向けRMP資材を作成しております。
■投与対象患者の選択 3. 注意が必要な患者■
以下のリンクから、ご参照ください。
参考資料:
電子添文
【医療従事者向けRMP資材】タバリス錠100mg・150mg投与における注意事項
〔2025年1月改訂〕-
Q13.タバリス錠は高齢者に投与してもよいですか?
一般に高齢者では生理機能が低下していることが多いため、患者の状態を観察しながら慎重に投与してください。
参考資料:
電子添文
〔2024年6月改訂〕-
Q14.タバリス錠と併用注意の薬剤はありますか?
ホスタマチニブは、P-糖蛋白質(P-gp)及び乳がん耐性蛋白質(BCRP)に対して阻害作用を有します。また、ホスタマチニブの活性本体であるR406は、主としてCYP3A4により代謝され、BCRPに対して阻害作用を有し、CYP3Aに対して弱い阻害作用を有します。
以下の薬剤との併用に注意してください。
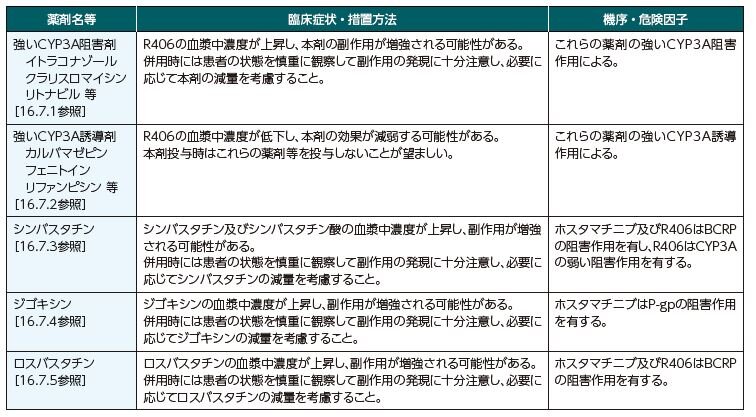
参考資料:
電子添文
〔2024年6月改訂〕-
Q15.タバリス錠の副作用について教えてください。
タバリス錠の重大な副作用は、重度の下痢(1.7%)、高血圧、好中球減少、感染症、肝機能障害(17.3%)があります。
重度の下痢では、必要に応じて電解質や腎機能検査を行い、患者の状態により止瀉薬の投与、補液などの適切な処置を行ってください。
高血圧では、高血圧(21.2%)、高血圧クリーゼ(0.6%)があらわれることがあります。必要に応じて降圧剤の投与などの適切な処置を行ってください。
好中球減少では、好中球減少(5.6%)、発熱性好中球減少症(0.6%)があらわれることがあります。
感染症では、肺炎(1.1%)等の感染症があらわれることがあります。患者の状態を十分観察し、異常が認められた場合は、抗菌剤の投与などの適切な処置を行ってください。
肝機能障害では、ALT(8.4%)、AST(5.6%)、ビリルビン(2.2%)等の上昇を伴う肝機能障害があらわれることがあります。また、その他の副作用は、以下のとおりです。
これらの副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には、投与を中止するなど適切な処置を行ってください。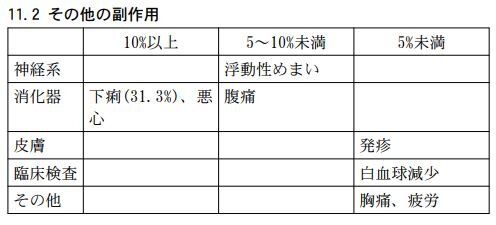
タバリス錠の国内第Ⅲ相試験(二重盲検期)で認められた副作用は、以下のとおりです。
同意取得の6ヵ月以上前に特発性血小板減少性紫斑病(ITP)と診断され、少なくとも1種類のITP治療薬(副腎皮質ステロイド、TPO受容体作動薬、リツキシマブ又はIVIG製剤)を使用しても十分な効果が得られなかった又は忍容性に問題があると考えられた20歳以上の慢性特発性血小板減少性紫斑病患者(血小板数が30,000/μL未満)34例(タバリス錠群22例、プラセボ群12例)を対象に、タバリス錠1回100mg 1日2回より投与を開始し、血小板数の増加が認められず、安全性に問題がない場合は150mg1日2回に増量して24週間経口投与しました。血小板数及び安全性等に応じて、100mg1日1回~150mg1日2回の範囲で用量調整しました。
副作用発現割合は、タバリス錠群77.3%(17/22例)、プラセボ群8.3%(1/12例)でした。タバリス錠群の主な副作用は、下痢31.8%(7/22例)、高血圧27.3%(6/22例)及び好中球数減少13.6%(3/22例)でした。中等度又は高度の出血関連の副作用は認められませんでした。
その他の臨床試験における副作用は、電子添文【17.臨床成績】をご参照ください。参考資料:
電子添文
〔2024年6月改訂〕-
Q16.タバリス錠の副作用「下痢」の対処方法を教えてください。
- 必要に応じて電解質や腎機能検査を行い、患者の状態により止瀉薬の投与、補液などの適切な処置を行ってください。
タバリス錠の用量調節については下図を目安にしてください。
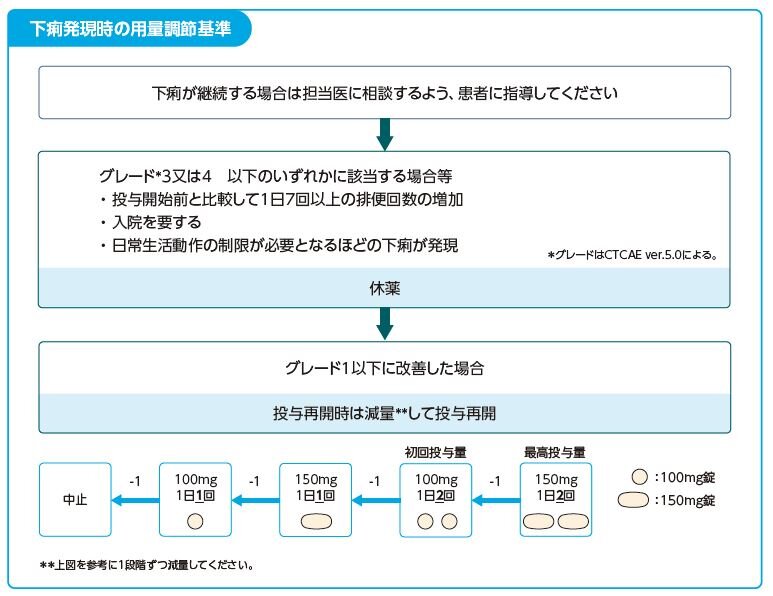
タバリス錠は医療従事者向けRMP資材を作成しております。
■注意すべき副作用とその対策 1. 下痢■
以下のリンクから、ご参照ください。
参考資料:
【医療従事者向けRMP資材】タバリス錠100mg・150mg投与における注意事項
〔2025年1月改訂〕 -
Q17.タバリス錠の副作用「高血圧」の対処方法を教えてください。
- 必要に応じて降圧剤の投与などの適切な処置を行ってください。
タバリス錠の用量調節については下図を目安にしてください。
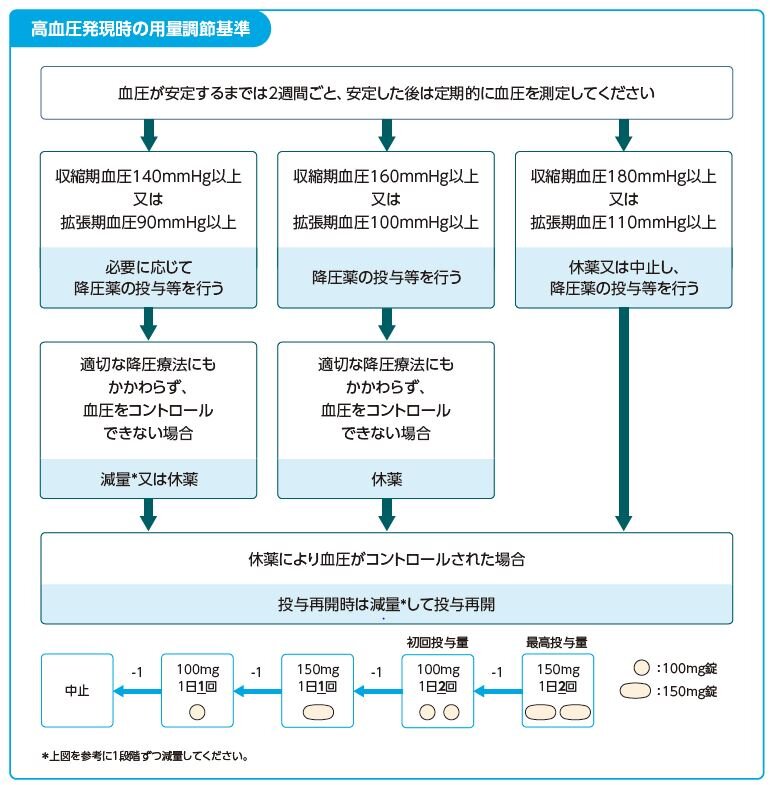
タバリス錠は医療従事者向けRMP資材を作成しております。
■注意すべき副作用とその対策 2. 高血圧■
以下のリンクから、ご参照ください。
参考資料:
【医療従事者向けRMP資材】タバリス錠100mg・150mg投与における注意事項
〔2025年1月改訂〕 -
Q18.タバリス錠の副作用「肝機能障害」の対処方法を教えてください。
- 下図を目安にタバリス錠を休薬するなど、適切な処置を行ってください。
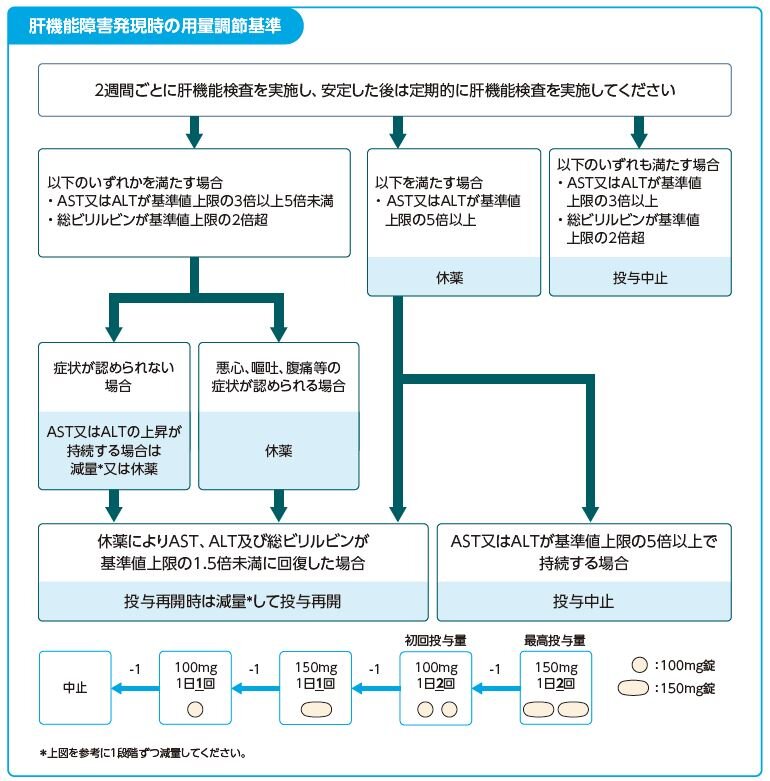
タバリス錠は医療従事者向けRMP資材を作成しております。
■注意すべき副作用とその対策 3. 肝機能障害■
以下のリンクから、ご参照ください。
参考資料:
【医療従事者向けRMP資材】タバリス錠100mg・150mg投与における注意事項
〔2025年1月改訂〕 -
Q19.タバリス錠の副作用「好中球減少」の対処方法を教えてください。
- 下図を目安にタバリス錠を休薬するなど、適切な処置を行ってください。
感染症の発現に注意してください。感染徴候が認められた場合は、Q.20. の項も、参照してください。
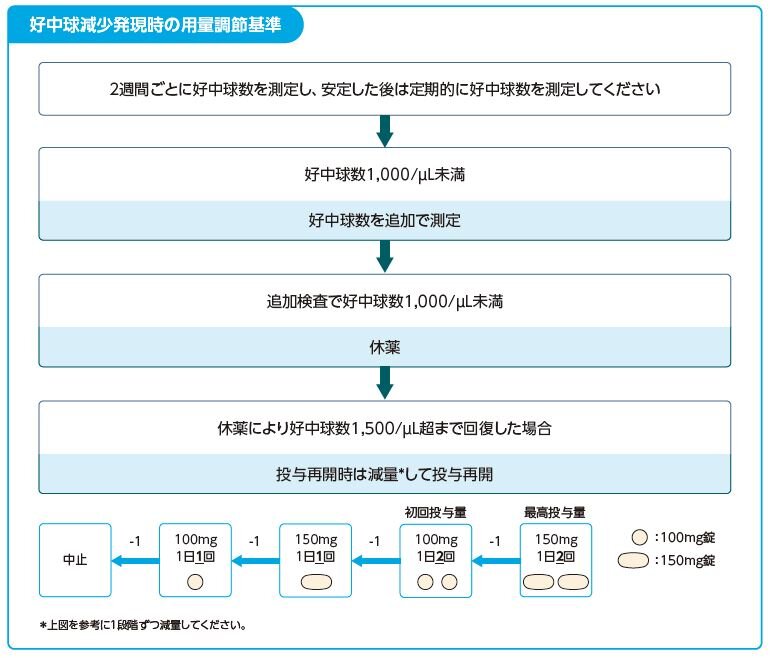
タバリス錠は医療従事者向けRMP資材を作成しております。
■注意すべき副作用とその対策 4. 好中球減少■
以下のリンクから、ご参照ください。
参考資料:
【医療従事者向けRMP資材】タバリス錠100mg・150mg投与における注意事項
〔2025年1月改訂〕 -
Q20.タバリス錠の副作用「感染症」の対処方法を教えてください。
- 患者の状態を十分観察し、異常が認められた場合は、抗菌剤の投与や、タバリス錠の減量*又は休薬など、適切な処置を行ってください。
定期的に血液検査を実施し、感染症の増悪に注意してください。
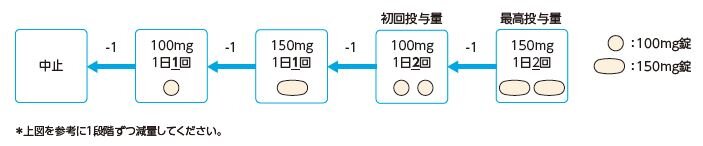
タバリス錠は医療従事者向けRMP資材を作成しております。
■注意すべき副作用とその対策 5. 感染症■
以下のリンクから、ご参照ください。
参考資料:
【医療従事者向けRMP資材】タバリス錠100mg・150mg投与における注意事項
〔2025年1月改訂〕 -
Q21.タバリス錠の医薬品リスク管理計画書(RMP)及び関連資料はありますか?
タバリス錠のRMP及び関連資材は、以下のリンクからご参照ください。
■タバリス錠100mg・タバリス錠150mgに係る医薬品リスク管理計画書(RMP)■
■【医療従事者向けRMP資材】タバリス錠100mg・150mg投与における注意事項■
■【患者さん向けRMP資材】タバリス錠による治療を受ける方へ■
参考資料:
タバリス錠100mg・タバリス錠150mgに係る医薬品リスク管理計画書(RMP)
【医療従事者向けRMP資材】タバリス錠100mg・150mg投与における注意事項
【患者さん向けRMP資材】タバリス錠による治療を受ける方へ
〔2025年1月作成〕-
Q22.タバリス錠の代謝について教えてください。
ホスタマチニブは、小腸でアルカリホスファターゼ(ALP)により、活性本体であるR406に代謝されます(in vitro)。R406は主に、CYP3A4及びUDPグルクロン酸転移酵素(UGT1A9)により代謝されます(in vitro)。健康被験者6例を対象に、[14C]ホスタマチニブ150mgを空腹時に単回経口投与したとき注)、血漿中では主にR406として存在し、R406の代謝物はわずかでした(外国人データ)。
注)タバリス錠の承認されている用法及び用量は、「通常、成人には、ホスタマチニブとして初回投与量100mgを1日2回、経口投与する。初回投与量を4週間以上投与しても目標とする血小板数の増加が認められず、安全性に問題がない場合は150mgを1日2回に増量する。なお、血小板数、症状に応じて適宜増減するが、最高投与量は1回150mgを1日2回とする。」です。
参考資料:
電子添文
〔2025年1月改訂〕-
Q23.タバリス錠の排泄について教えてください。
健康被験者6例を対象に[14C]ホスタマチニブ150mgを空腹時に単回経口投与したとき注)、投与された放射能の19.3%が尿中に排出されました。主に活性本体であるR406のN-グルクロン酸抱合体として存在し、R406の尿中排泄はわずかでした。残りの放射能(80.0%)は糞中に排泄され、主にR406及びR406のベンゼンジオール体として存在していました(外国人データ)。
注)タバリス錠の承認されている用法及び用量は、「通常、成人には、ホスタマチニブとして初回投与量100mgを1日2回、経口投与する。初回投与量を4週間以上投与しても目標とする血小板数の増加が認められず、安全性に問題がない場合は150mgを1日2回に増量する。なお、血小板数、症状に応じて適宜増減するが、最高投与量は1回150mgを1日2回とする。」です。
参考資料:
電子添文
〔2025年1月改訂〕-
Q24.タバリス錠の作用機序について教えてください。
ホスタマチニブは、生体内で活性本体であるR406に代謝され、脾臓チロシンキナーゼを阻害します。
R406は、脾臓チロシンキナーゼを阻害することで、マクロファージに発現するFcγ受容体を介したシグナル伝達を抑制し、抗血小板自己抗体が結合した血小板のマクロファージによる貪食及び破壊を軽減します。
また、B細胞に発現するB細胞受容体を介したシグナル伝達を抑制することで、B細胞の抗血小板抗体産生を抑制する可能性があります。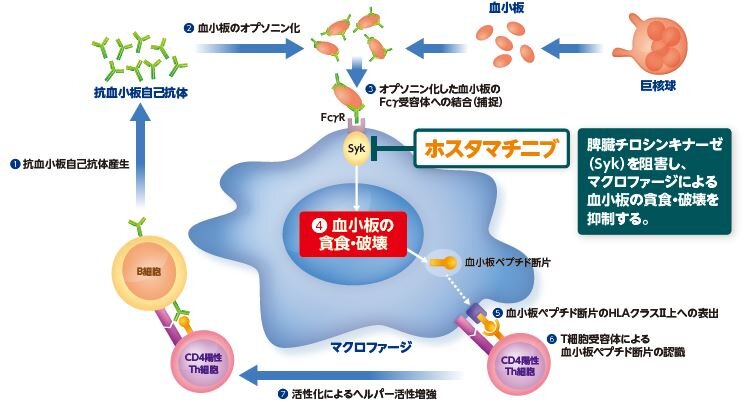
参考資料:
電子添文
インタビューフォーム
〔2025年1月改訂〕-
Q25.タバリス錠の製剤の安定性を教えてください。
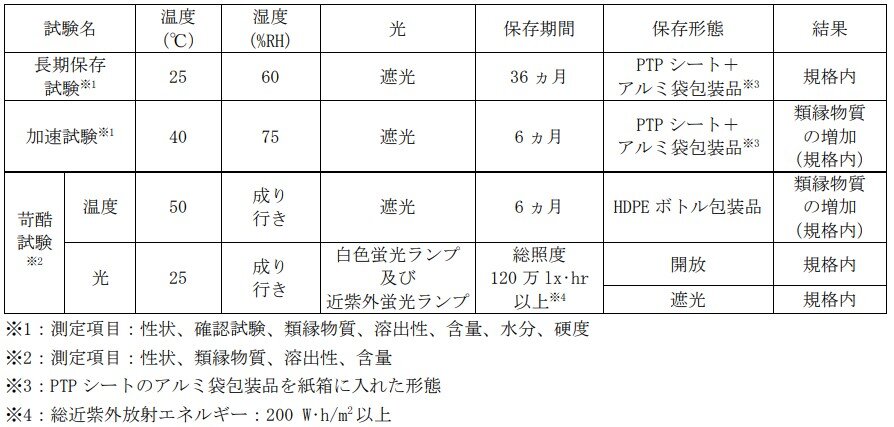
タバリス錠の安定性は、以下のとおりです。
1)タバリス錠100mg錠及び同150mg錠の各種条件下における安定性試験結果
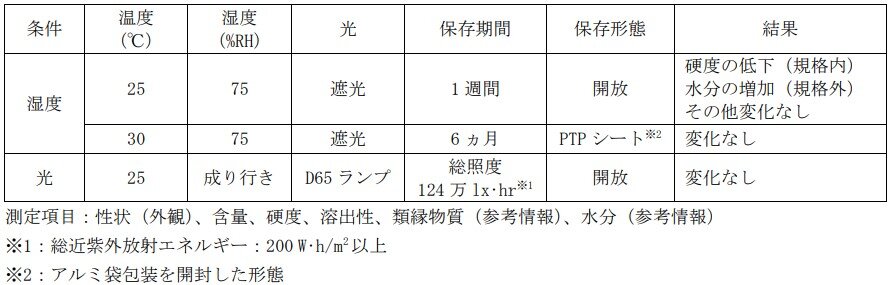
2)タバリス錠100mg及び同150mgの無包装及びアルミ袋開封後の安定性
「錠剤・カプセル剤の無包装状態での安定性試験法について(答申)(日本病院薬剤師会)(平成11年8月20日付)」の評価方法に準じた安定性情報を以下に示す。
なお、タバリス錠は吸湿により溶出性に影響を及ぼすことがあるため、アルミピロー開封後は PTP シートの状態で保存すること。(「X.4.取扱い上の注意」の項参照)
参考資料:
インタビューフォーム
〔2025年1月改訂〕-
Q26.タバリス錠の海外での承認・発売状況を教えてください。
欧米を含む31ヵ国で承認されています(2022年9月現在)。
なお、本邦における効能又は効果、用法及び用量は、海外での承認状況とは異なります。タバリス錠の電子添文に記載されている承認内容の範囲で、タバリス錠を使用してください。参考資料:
インタビューフォーム
審査報告書
〔2025年1月改訂〕-
Q27.タバリス錠は全例調査の対象ですか?
タバリス錠は、全例調査の対象です。
<補足>
タバリス錠の全例調査は、目標症例数の登録が完了したため、新規の登録は実施しておりません。
ただし、「2024年9月末までにタバリス錠を投与開始した症例」は、現在でも登録対象です。参考資料:
電子添文
〔2025年1月改訂〕-
Q28.タバリス錠の崩壊・懸濁性及び経管チューブの通過性に関する情報を教えてください。
本内容には承認を受けていない品質に関する情報が含まれています。試験方法等が確立していない内容も含まれており、あくまでも記載されている試験方法で得られた結果を事実として提示しています。医療従事者が臨床適用を検討する上での参考情報であり、加工等の可否を示すものではありません。
インタビューフォーム XIII.備考「1.調剤・服薬支援に際して臨床判断を行うにあたっての参考情報」に掲載しております。
■崩壊・懸濁性及び経管投与チューブの通過性■
以下のリンクから、ご参照ください。
注:タバリス錠の承認されている用法及び用量は、「通常、成人には、ホスタマチニブとして初回投与量100mgを1日2回、経口投与する。初回投与量を4週間以上投与しても目標とする血小板数の増加が認められず、安全性に問題がない場合は150mgを1日2回に増量する。なお、血小板数、症状に応じて適宜増減するが、最高投与量は1回150mgを1日2回とする。」です。懸濁して投与する方法は、タバリス錠の承認された用法及び用量ではありません。また、タバリス錠を懸濁した製品での臨床試験、薬物動態、安定性、有効性及び安全性等のデータはなく、タバリス錠の懸濁投与は推奨しません。
参考資料:
インタビューフォーム
〔2025年1月改訂〕





