![]()
日本から発信されたサイエンス直腸扁平上皮化と潰瘍性大腸炎関連腫瘍の領域拡大における上皮置換の寄与
方法・結果
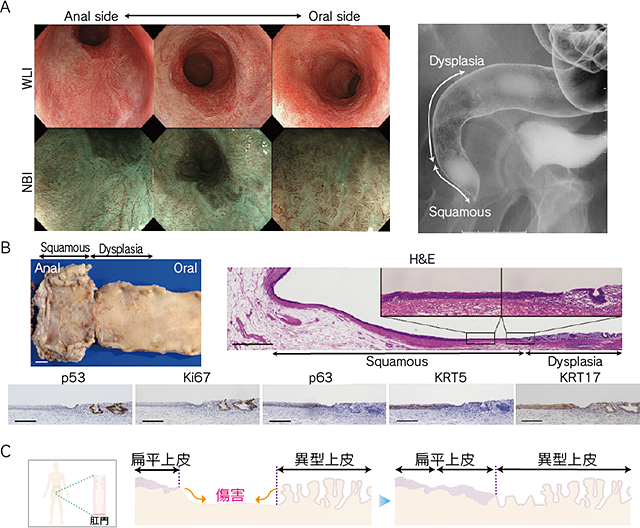
マウスにおいて直腸扁平上皮化を再現できたことから,UC患者においても同様の現象が起こっているのではないかと考え,臨床において検証することとした.ヒトの上皮細胞をヒトの体内でマーキングすることはできないため,かわりに病理組織学的に異なる上皮を同定可能なUCAN患者を対象に選択した.当院のUCANコホート86人の患者のうち,直腸に早期がんもしくはdysplasia(異形成)を有していた34人について検索し,このうち,後ろ向きの検討で肛門から連続した直腸扁平上皮化が内視鏡的に明らかに存在する患者が3人同定された.このCase #1では,扁平上皮化が肛門管から4cm,high-grade dysplasiaが直腸S状結腸まで6cmにも及んでおり,狭帯域光観察(narrow band imaging:NBI)で容易に扁平上皮の存在を認識できた.病理学的には,p63+KRT5+KRT17+の移行性扁平上皮がp53+異形成上皮と境界を形成していた(図❷A,B).p53+の異形成上皮の一部では,上皮の単層が再生し,陰窩構造を形成していない部位があり,p53+細胞が上皮の再生過程で領域を形成しながら拡大している様子が示唆された(図❷C).
つぎに,p63+KRT5+KRT17+の移行性扁平上皮が,マウスと同様にUC患者でも傷害を再生できるかどうかを検証した.長期にわたり変化のない肛門から直腸Raに及ぶ広範囲の扁平上皮化に隣接するUCANを内視鏡的粘膜下層剝離術(endoscopic submucosal dissection:ESD)で治療したCase#2では,治療後の経時的変化を記録していた.周囲の扁平上皮とともにlow-grade dysplasiaを含む円柱上皮を切除した後,ESDによって生じた治療後潰瘍は,周囲のKRT17+扁平上皮に置換され,予想通り,扁平上皮の領域が拡大していた.耐術能の問題で大腸全摘術を回避し,経肛門的内視鏡下マイクロサージェリーにアルゴンプラズマ凝固法(argon plasma coagulation:APC)を追加して治療されたCase #3においても直腸扁平上皮化が認められた.扁平上皮との境界で異所性再発したdysplasiaにAPCをくり返しおこなった結果,APC後に扁平上皮の領域拡大が内視鏡的に確認された.これらの結果から,炎症もしくは人工的に作成された上皮の欠損は,たとえ性質が異なるものだとしても,周囲の上皮の進展によって修復される可能性があることが示唆された.
考察
大腸上皮は,陰窩の分裂を介して傷害が修復されるが,健常な大腸ではそのような頻度は低い.一方,UCやバレット食道などの炎症性疾患では,その再生過程で,本来の上皮とは異なる上皮の領域拡大が起こることがある7).ゲノム解析技術の進歩により,マウスにおいてこのような現象の理解が進んできたが,ヒトでどのように異なる上皮が再生されるかを検証する方法は限定されており,その理解は不十分である8)~10).われわれは,これまでに蓄積してきたUCANコホートを活用し,異なる上皮が大腸上皮を修復する直腸扁平上皮化というまれな現象がヒトにおいても存在することを確認した.上皮の置換には陰窩の完全な除去が不可欠であることであり3),上皮の置換あるいは領域拡大は,陰窩構造が欠損するような慢性炎症による激しい破壊―修復のくり返しの存在を示唆している.異なる上皮で傷害が修復されるのは,炎症に抵抗性の残存上皮による迅速な創傷修復を達成するための防御機構の結果であるかもしれない.実際にマウスの肛門直腸移行部の扁平上皮には幹細胞の性質があることが示されている8)~10).また,IL-17Aシグナル伝達経路などの炎症遺伝子に変異をもつ非腫瘍のクローンが,UC患者の大腸上皮を広範囲にわたり領域形成していることもわかってきている11).直腸扁平上皮化が確認された際には,内視鏡医は,変異を保有する細胞による周囲の上皮による領域形成が存在する可能性にとくに注意を払いながら,UCANのサーベイランスを実施すべきである.
- 文献
- 1)Sugimoto S, Naganuma M, Iwao Y et al:Endoscopic morphologic features of ulcerative colitis-associated dysplasia classified according to the SCENIC consensus statement. Gastrointest Endosc 85:639-646.e2, 2017
- 2)Maruoka T, Hasegawa K, Nagasako K:Squamous cell metaplasia without dysplasia of the colonic mucosa in ulcerative colitis. Gastrointest Endosc 36:65-66, 1990
- 3)Sugimoto S, Ohta Y, Fujii M et al:Reconstruction of the Human Colon Epithelium In Vivo. Cell Stem Cell 22:171-176.e5, 2018
- 4)Kawasaki K, Fujii M, Sugimoto S et al:Chromosome Engineering of Human Colon-Derived Organoids to Develop a Model of Traditional Serrated Adenoma. Gastroenterology 158:638-651.e8, 2020
- 5)Sugimoto S, Kobayashi E, Fujii M et al:An organoid-based organ-repurposing approach to treat short bowel syndrome. Nature 592:99-104, 2021
- 6)Togasaki K, Sugimoto S, Ohta Y et al:Wnt Signaling Shapes the Histologic Variation in Diffuse Gastric Cancer. Gastroenterology 160:823-830, 2021
- 7)Kakiuchi N, Ogawa S:Clonal expansion in non-cancer tissues. Nat Rev Cancer 21:239-256, 2021
- 8)Jiang M, Li H, Zhang Y et al:Transitional basal cells at the squamous-columnar junction generate Barrett's oesophagus. Nature 550:529-533, 2017
- 9)Mitoyan L, Chevrier V, Hernandez-Vargas H et al:A stem cell population at the anorectal junction maintains homeostasis and participates in tissue regeneration. Nature Communications 12:2761, 2021
- 10)Liu CY, Girish N, Gomez ML et al:Transitional Anal Cells Mediate Colonic Re-epithelialization in Colitis. Gastroenterology 162:1975-1989, 2022
- 11)Nanki K, Fujii M, Shimokawa M et al:Somatic inflammatory gene mutations in human ulcerative colitis epithelium. Nature 577:254-259, 2020