グルファストとボグリボースの併用試験成績
有効性・安全性
試験デザイン1)、2)
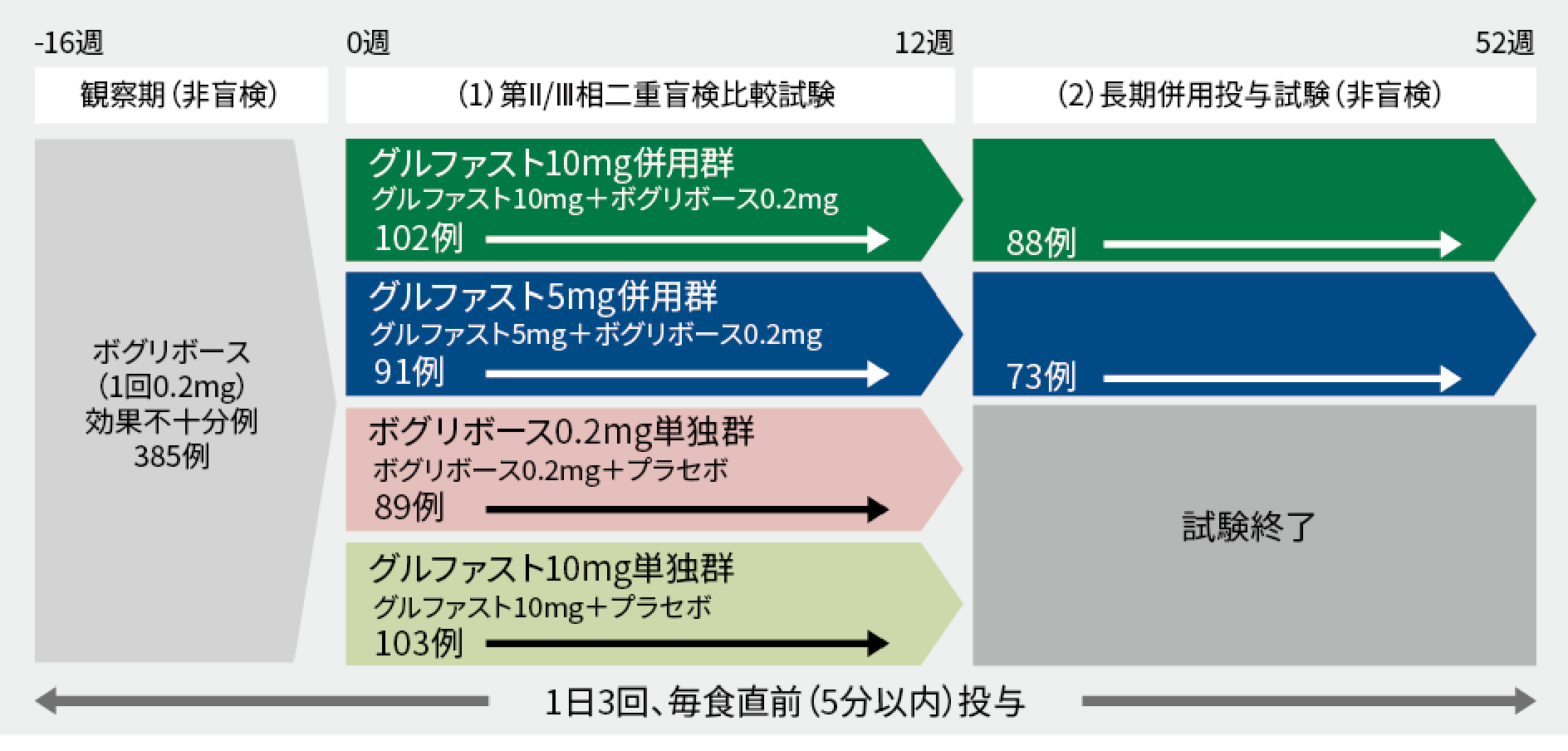
1) 承認時評価資料: 第Ⅱ/Ⅲ相二重盲検比較試験より作図
2) 承認時評価資料: 長期併用投与試験より作図
グルファストとボグリボースの併用試験成績
第Ⅱ/Ⅲ相二重盲検比較試験(優越性検証試験)1)、3)
1) 承認時評価資料: 第Ⅱ/Ⅲ相二重盲検比較試験
3) Kaku K et al. Jpn Pharmacol Ther. 2007; 35 Suppl 1: S51-72.
COI: 本試験はキッセイ薬品工業株式会社の資金提供を受けて実施された。
本試験成績におけるグルファスト1回5mg・ボグリボース1回0.2mg併用群は本剤(グルベス®配合錠・グルベス®配合OD錠)の組成と異なるため、安全性に関する結果のみ掲載しています。
| 目的: | ボグリボース0.2mg単独群に対するグルファスト併用群(1回10mgまたは5mg)の優越性の検証 |
|---|---|
| 対象・症例数: | 食事療法に加えてボグリボース(1回0.2mg)単剤で十分な血糖コントロールが得られていない2型糖尿病患者385例 |
| 投与方法: | 観察期では、ボグリボース(1回0.2mg)を1日3回、毎食直前(食事開始前5分以内)に経口投与。治療期では、グルファスト(1回10mg)及びボグリボース(1回0.2mg)、グルファスト(1回5mg)及びボグリボース(1回0.2mg)、又はボグリボース(1回0.2mg)、グルファスト(1回10mg)のいずれかを、1日3回、12週間、毎食直前に経口投与。 |
| 主要評価項目: | 0週時に対する最終評価時のHbA1cの変化量 |
| 副次評価項目: | HbA1c(測定値、目標達成率※、改善率)、空腹時血糖値(FPG)、食後血糖値(1時間、2時間) |
| 安全性評価項目: | 有害事象及び副作用(全体、臨床症状、低血糖症状、臨床検査値)の発現率及び発現状況。臨床検査値、体重及び血圧の推移。 |
| 解析計画: |
※0週時のHbA1cが6.9%以上の症例のうち、最終評価時に6.9%未満へ到達した症例の割合 |
本試験ではHbA1cをJDSからNGSPへ換算しています。HbA1c(NGSP)=HbA1c(JDS)+0.4%
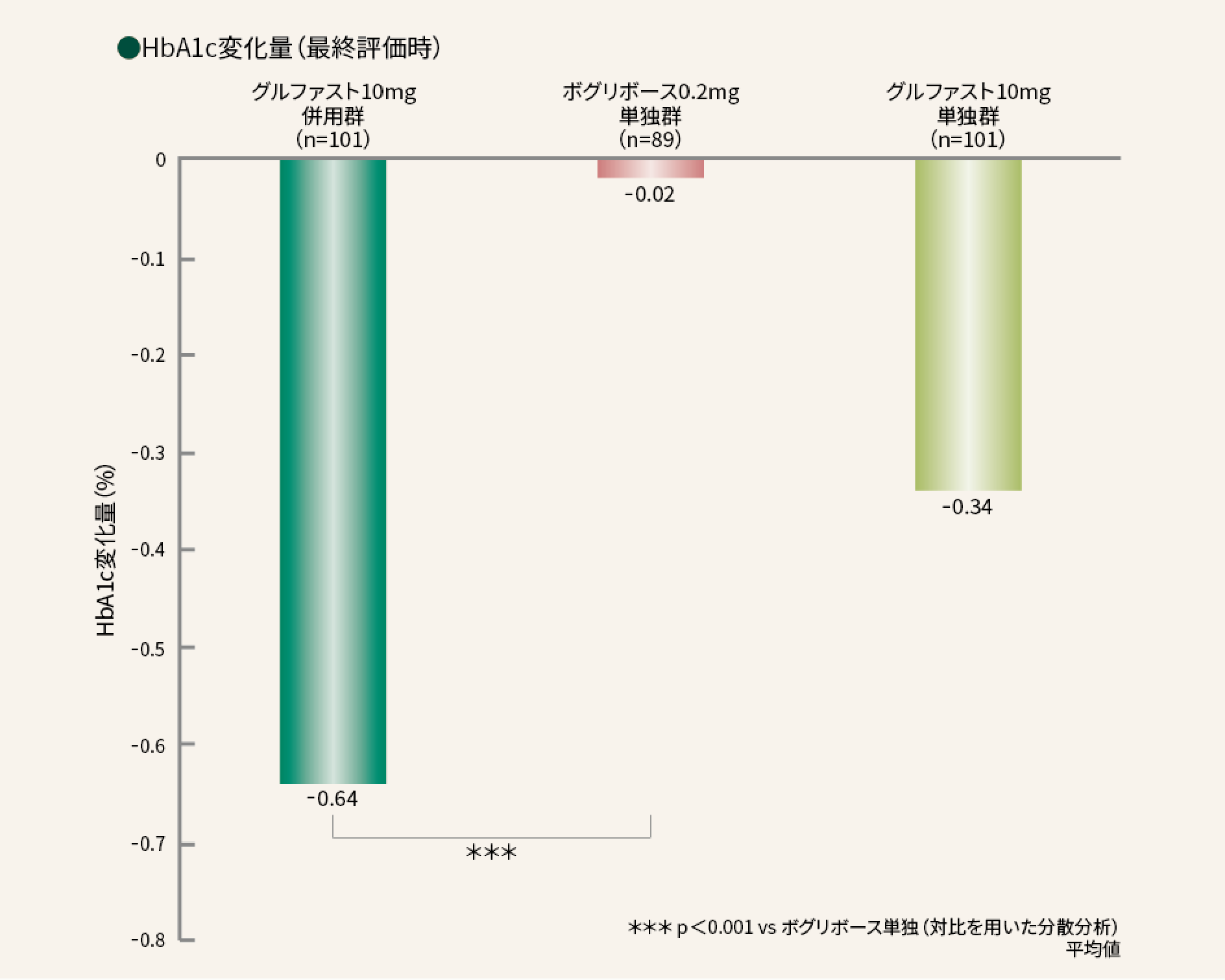
■ 0週時に対する最終評価時のHbA1c変化量主要評価項目(検証的解析結果)
0週時から最終評価時のHbA1c変化量は、グルファスト10mg併用群で-0.64%、ボグリボース0.2mg単独群で-0.02%であり、グルファスト10mg併用群の優越性が検証された。
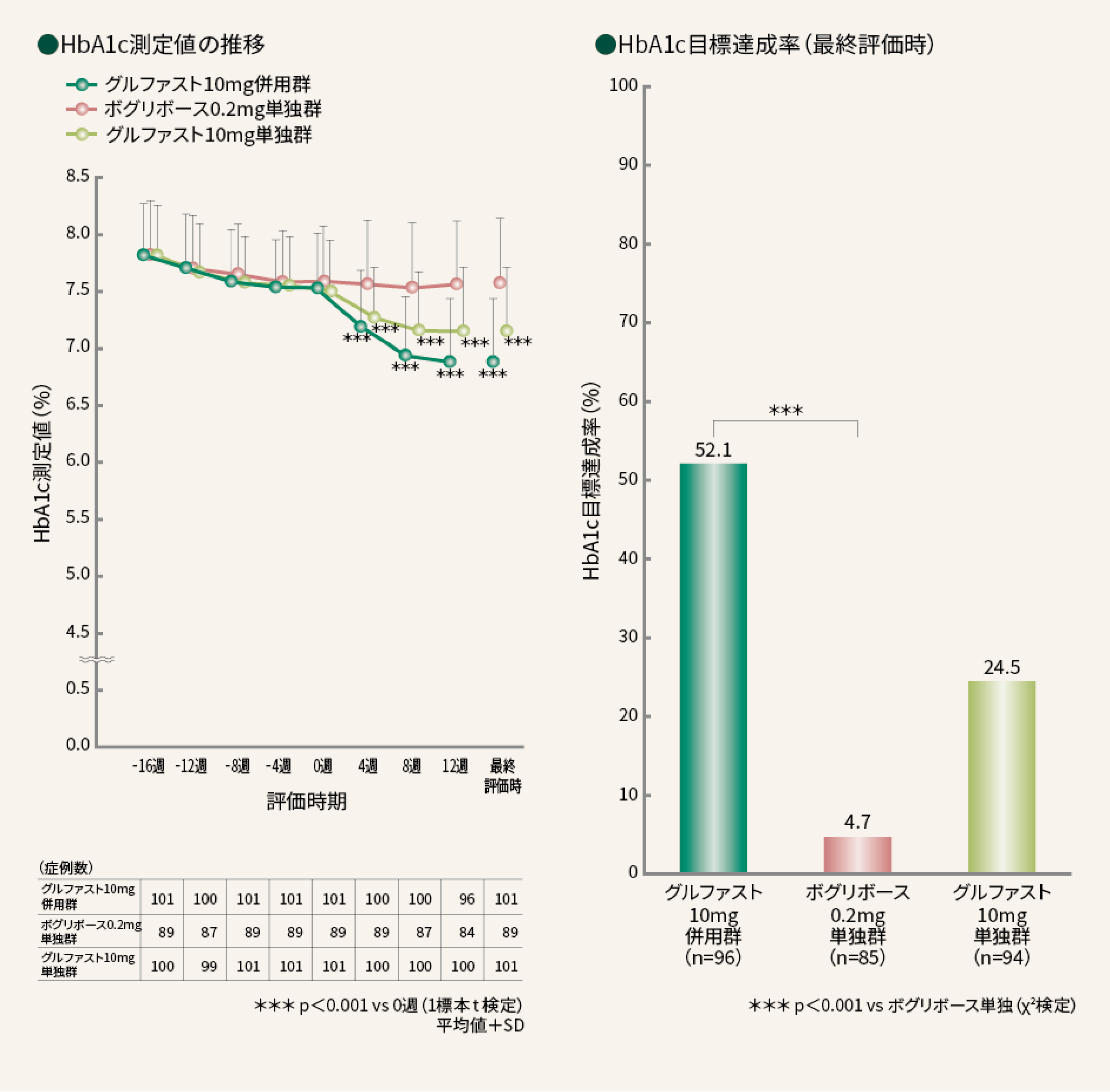
■ HbA1c測定値、目標達成率副次評価項目
HbA1c測定値は、グルファスト10mg併用群で0週時に対し4週目より有意に低下した。
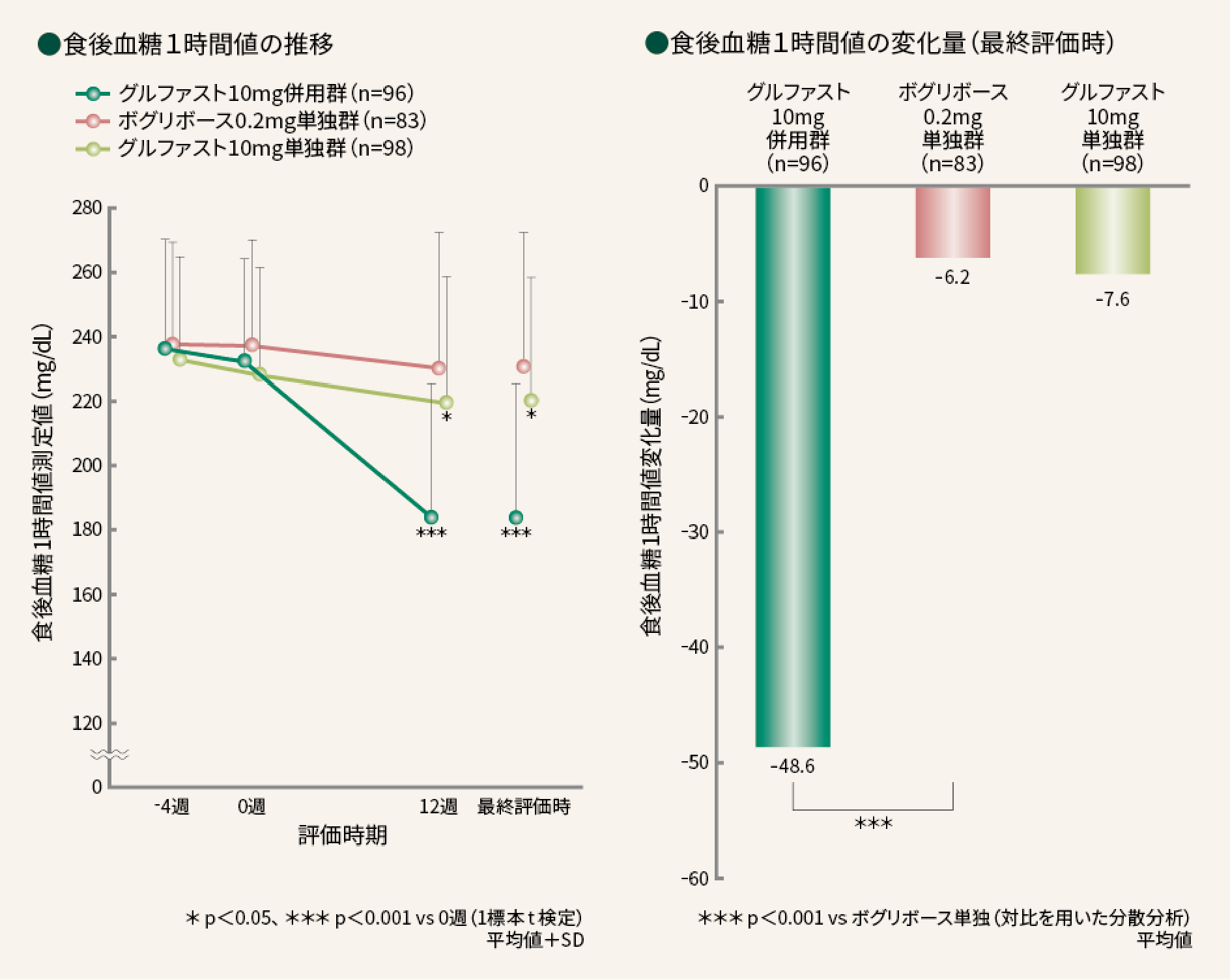
■ 食後血糖1時間値副次評価項目
最終評価時のグルファスト10mg併用群の食後血糖1時間値は、0週時に対し有意に低下した。
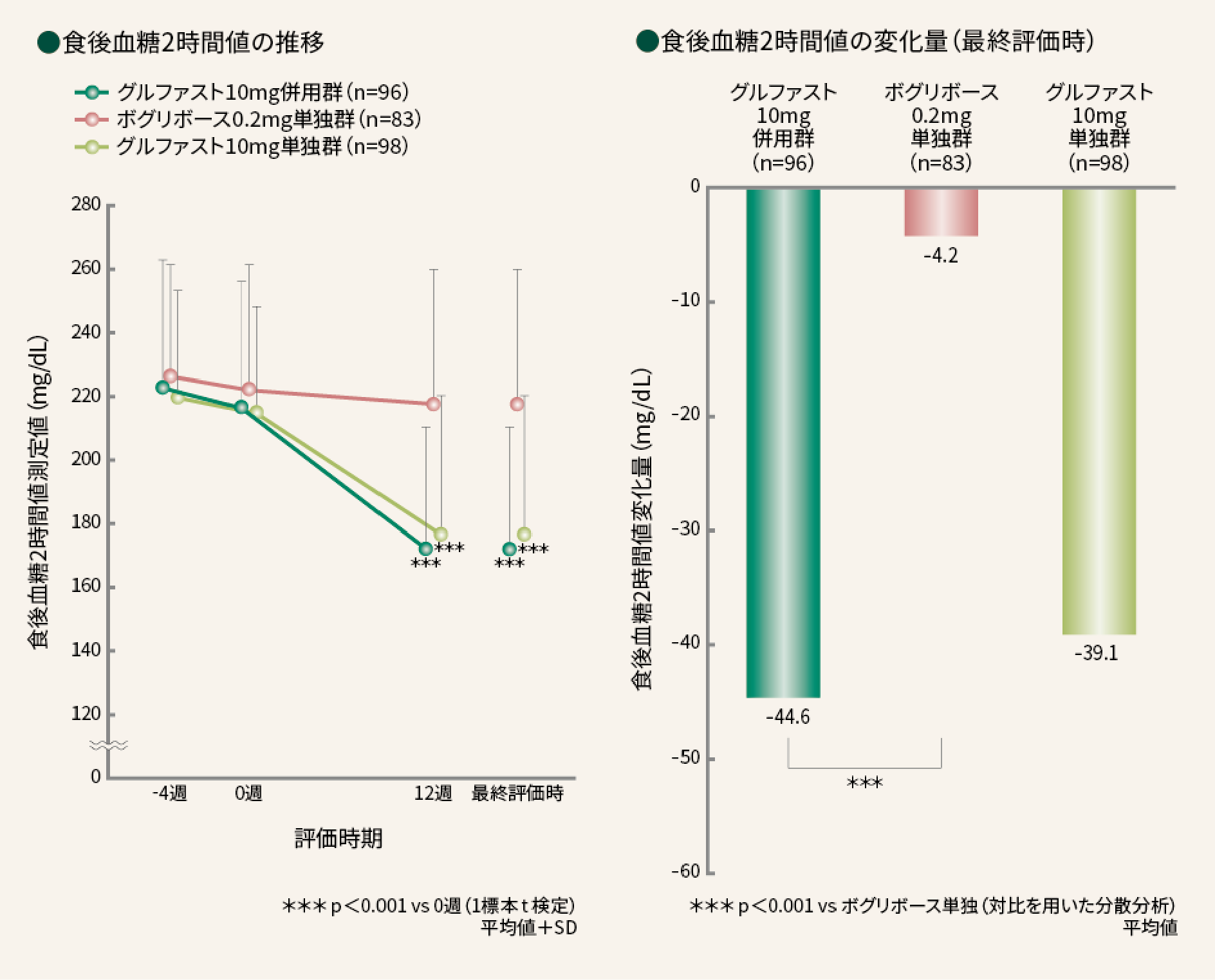
■ 食後血糖2時間値副次評価項目
最終評価時のグルファスト10mg併用群の食後血糖2時間値は、0週時に対し有意に低下した。
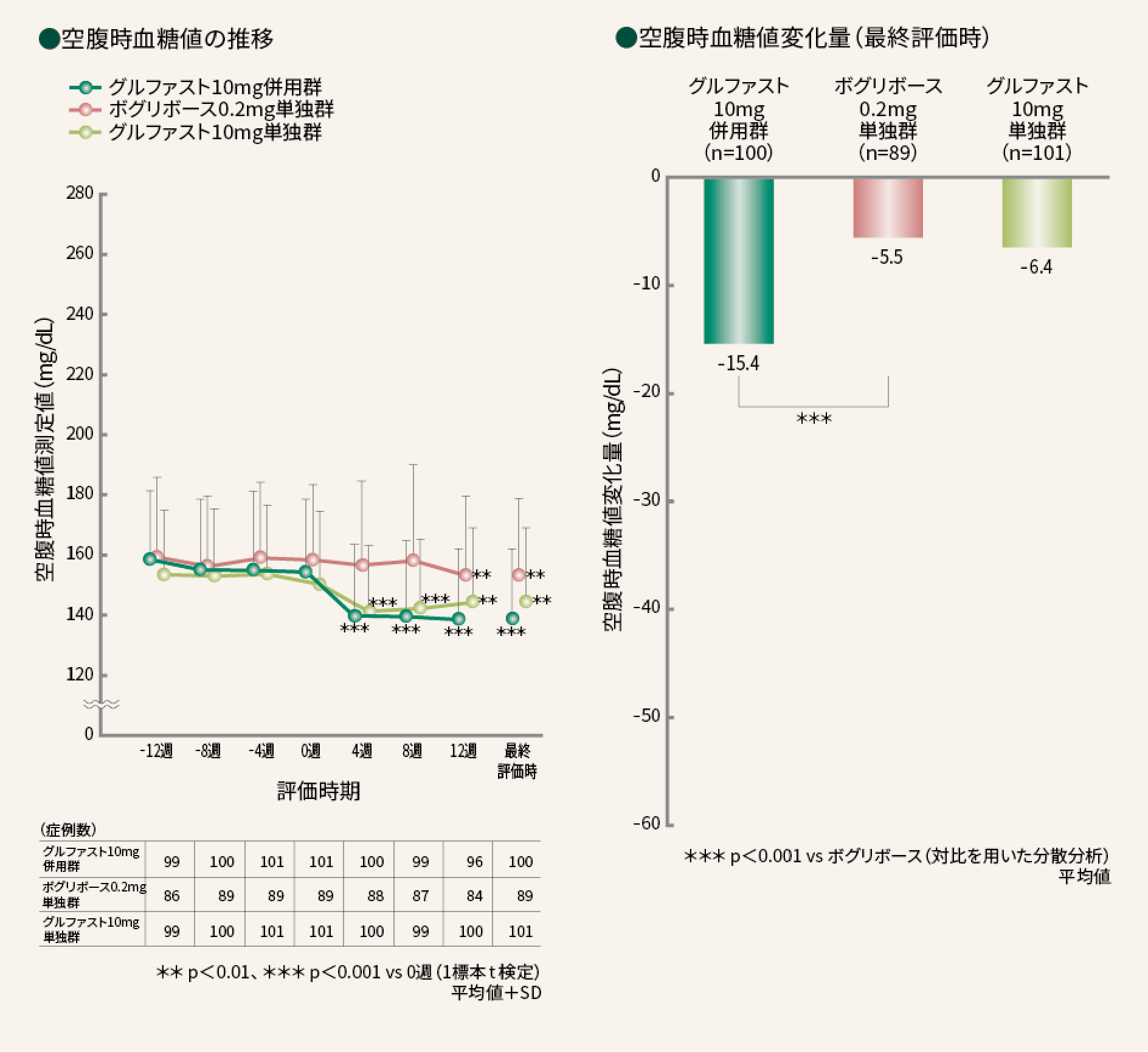
■ 空腹時血糖値(FPG)副次評価項目
空腹時血糖値は、グルファスト10mg併用群で0週時に対し4週目より有意に低下した。
■ 副作用
本試験における副作用(全体)の発現率は、グルファスト10mg併用群で34.7%(35/101例)、グルファスト5mg併用群で19.8%(18/91例)、ボグリボース単独群で25.8%(23/89例)、グルファスト10mg単独群で21.4%(22/103例)であった。低血糖症状の発現率はグルファスト10mg併用群で6.9%(7/102例)、グルファスト5mg併用群で3.3%(3/91例)、ボグリボース単独群で1.1%(1/89例)、グルファスト10mg単独群で3.9%(4/103例)であった。臨床症状の主な副作用(発現率3%以上)は、グルファスト10mg併用群で浮動性めまい、異常感、腹部膨満が各3.9%(4/102例)であった。臨床検査値の主な副作用(発現率3%以上)は、グルファスト10mg併用群でγ-GTP上昇が4.0%(4/101例)、グルファスト5mg併用群でAST上昇、γ-GTP上昇が各3.3%(3/91例)、ボグリボース単独群でALT上昇が3.4%(3/89例)であった。本試験において死亡例を含む重篤な副作用は認められなかった。なお、投与中止に至った副作用はグルファスト10mg併用群で異常感(1例)、グルファスト5mg併用群で腹部膨満、ALT上昇(各1例)、ボグリボース単独群で末梢性浮腫(1例)、グルファスト10mg単独群で異常感、浮動性めまい(各1例)が認められた。
4.効能又は効果
2型糖尿病
ただし、ミチグリニドカルシウム水和物及びボグリボースの併用による治療が適切と判断される場合に限る。
5.効能又は効果に関連する注意(抜粋)
- 5.2本剤を2型糖尿病治療の第一選択薬として用いないこと。
- 5.3原則として、以下の場合に本剤の使用を検討すること。
- 既にミチグリニドカルシウム水和物として1回10mg、1日3回及びボグリボースとして1回0.2mg、1日3回を併用し状態が安定している場合
- ミチグリニドカルシウム水和物として1回10mg、1日3回の単剤の治療により効果不十分な場合
- ボグリボースとして1回0.2mg、1日3回の単剤の治療により効果不十分な場合
- 5.4ミチグリニドカルシウム水和物又はボグリボースを使用している患者では、投与の際の空腹時血糖が126mg/dL以上、又は食後血糖1時間値又は2時間値が200mg/dL以上を目安とする。
6.用法及び用量
通常、成人には1回1錠(ミチグリニドカルシウム水和物/ボグリボースとして10mg/0.2mg)を1日3回毎食直前に経口投与する。
8.重要な基本的注意(抜粋)
- 8.3本剤投与中は、血糖を定期的に検査するとともに、経過を十分に観察し、本剤を2~3ヵ月投与しても効果が不十分な場合には、より適切と考えられる治療への変更を考慮すること。
グルファストとボグリボースの併用試験成績
長期併用投与試験2)、4)
2) 承認時評価資料: 長期併用投与試験
4) Kaku K et al. Jpn Pharmacol Ther. 2007; 35 Suppl 1: S73-91.
COI: 本試験はキッセイ薬品工業株式会社の資金提供を受けて実施された。
本試験成績におけるグルファスト1回5mg・ボグリボース1回0.2mg併用群は本剤(グルベス®配合錠・グルベス®配合OD錠)の組成と異なるため、安全性に関する結果のみ掲載しています。
| 目的: | グルファストとボグリボースを52週間併用投与したときの安全性及び有効性の検討 |
|---|---|
| 対象・症例数: | 第Ⅱ/Ⅲ相二重盲検比較試験において、本試験へ移行する同意が得られた2型糖尿病患者276例 |
| 投与方法: | グルファスト1回10mg及びボグリボース1回0.2mg、又はグルファスト1回5mg及びボグリボース1回0.2mgを、1日3回、毎食直前に52週間経口投与。 |
| 有効性評価項目: | HbA1c、空腹時血糖値(FPG)、食後血糖値(1時間、2時間) |
| 安全性評価項目: | 有害事象、副作用、臨床検査値、体重、血圧 |
| 解析計画: |
|
本試験ではHbA1cをJDSからNGSPへ換算しています。HbA1c(NGSP)=HbA1c(JDS)+0.4%
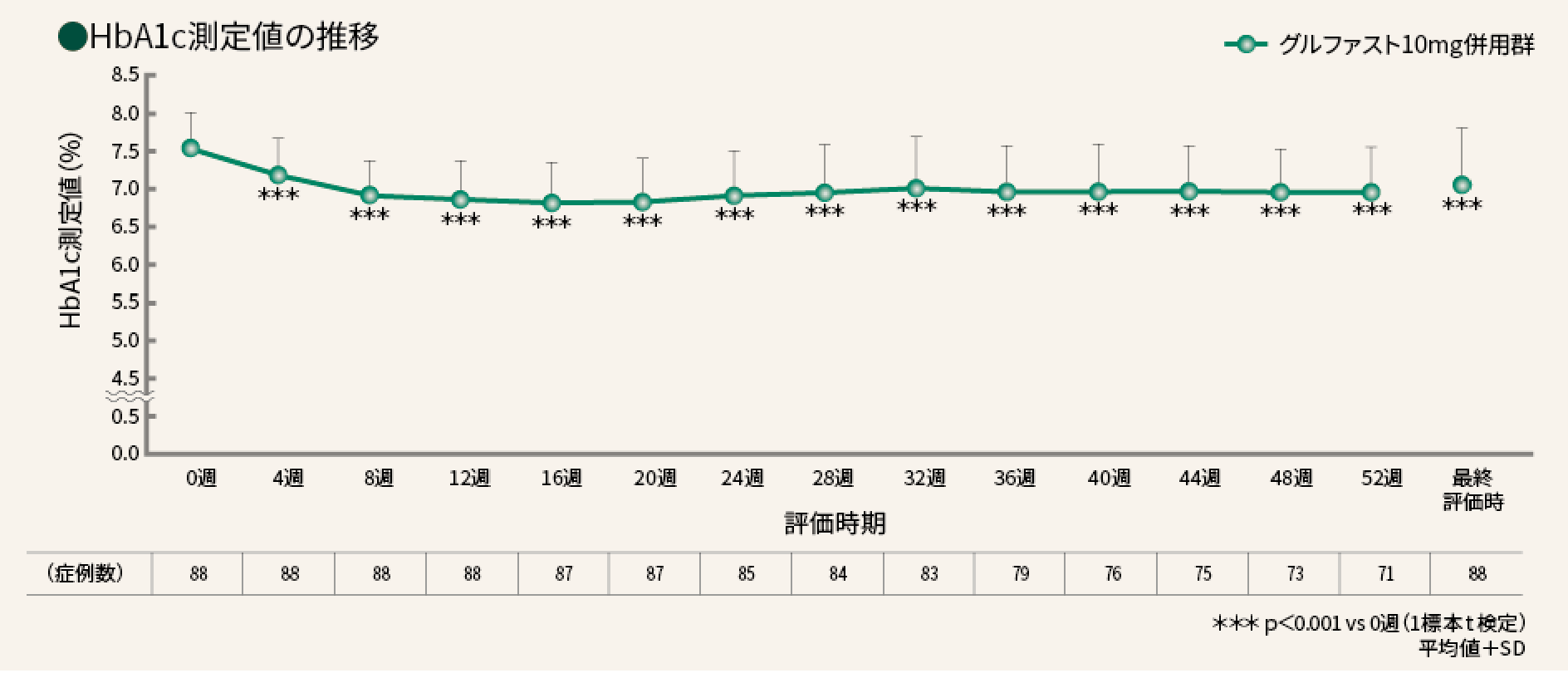
■ HbA1c
HbA1c測定値は、グルファスト10mg併用群ですべての評価時期で0週時に比べ有意に低下した。
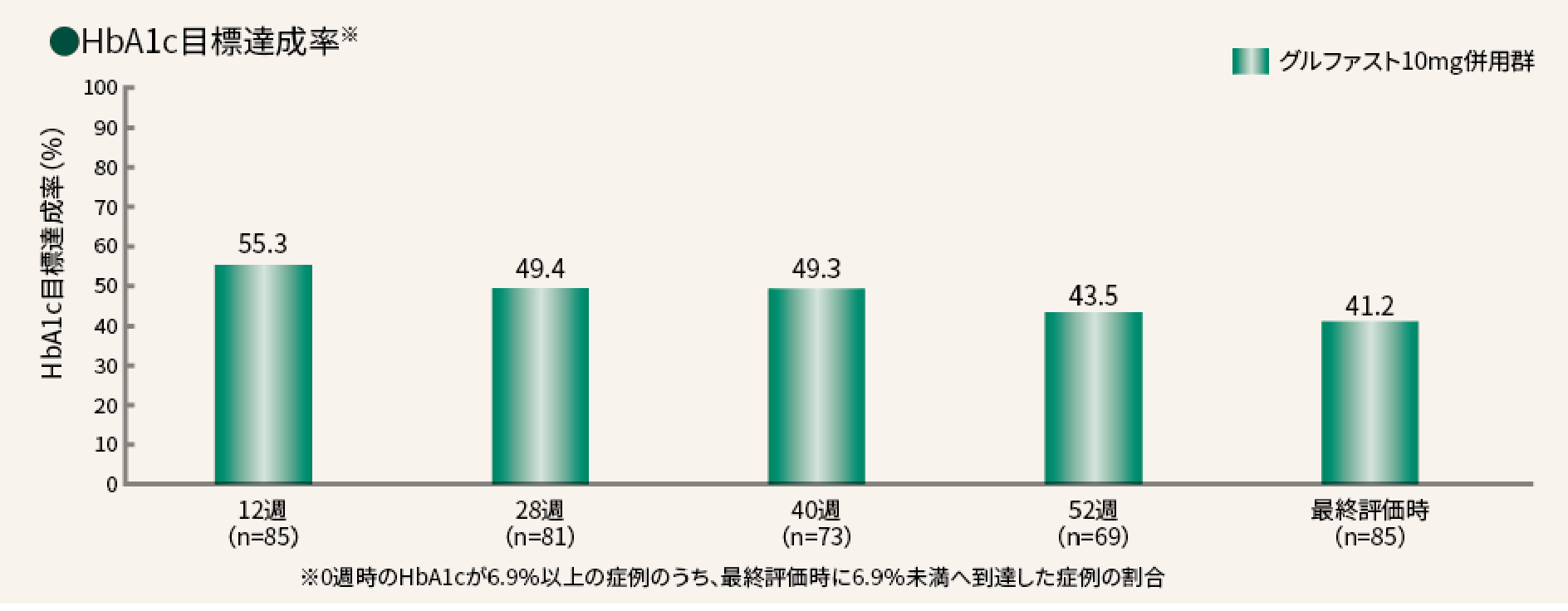
HbA1c6.9%未満へ到達した割合は、最終評価時において、グルファスト10mg併用群で41.2%(35/85例)であった。
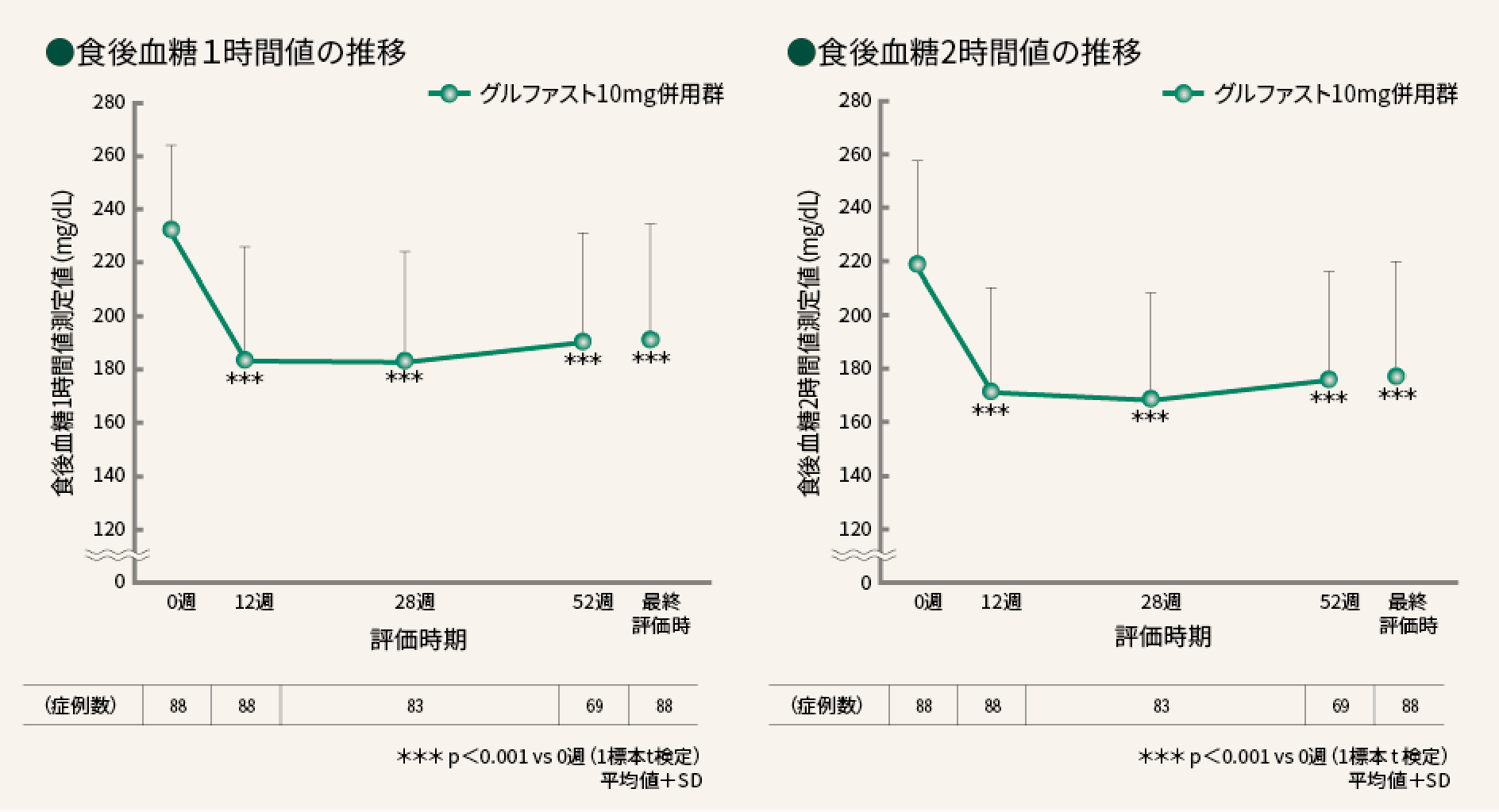
■ 食後血糖1時間値、2時間値
グルファスト10mg併用群の食後血糖1時間、2時間値測定値は、すべての評価時期で0週時に比べ有意に低下した。
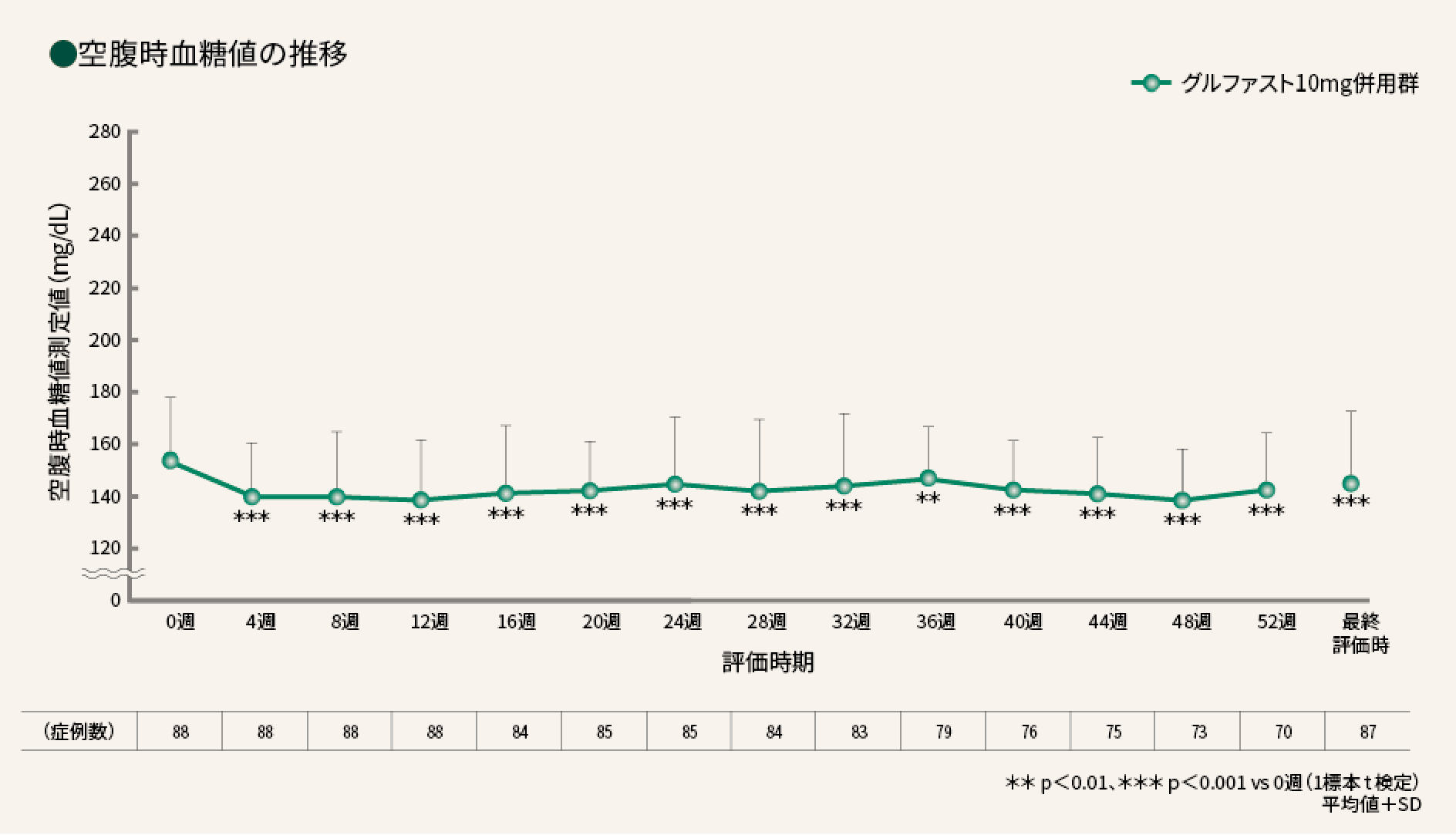
■ 空腹時血糖値(FPG)
空腹時血糖値測定値は、グルファスト10mg併用群ですべての評価時期で0週時に比べ有意に低下した。
■ 副作用
本試験における副作用(全体)の発現率は、グルファスト10mg併用群で45.5%(40/88例)、グルファスト5mg併用群で32.9%(24/73例)であった。低血糖症状の発現率はグルファスト10mg併用群で10.2%(9/88例)、グルファスト5mg併用群で2.7%(2/73例)であった。臨床症状の主な副作用(発現率3%以上)は、グルファスト10mg併用群で腹部膨満が5.7%(5/88例)、鼓腸が3.4%(3/88例)、浮動性めまいが4.5%(4/88例)、異常感が3.4%(3/88例)であった。臨床検査値の主な副作用(発現率3%以上)はグルファスト10mg併用群でγ-GTP上昇が4.5%(4/88例)、好酸球増加、ALT上昇、LDH上昇、TG上昇、BUN上昇、尿蛋白上昇が各3.4%(3/88例)、グルファスト5mg併用群でLDH上昇、尿酸上昇が各4.1%(3/73例)であった。本試験において死亡例を含む重篤な副作用は認められなかった。なお、投与中止に至った副作用はグルファスト5mg併用群で意識消失(1例)が認められた。
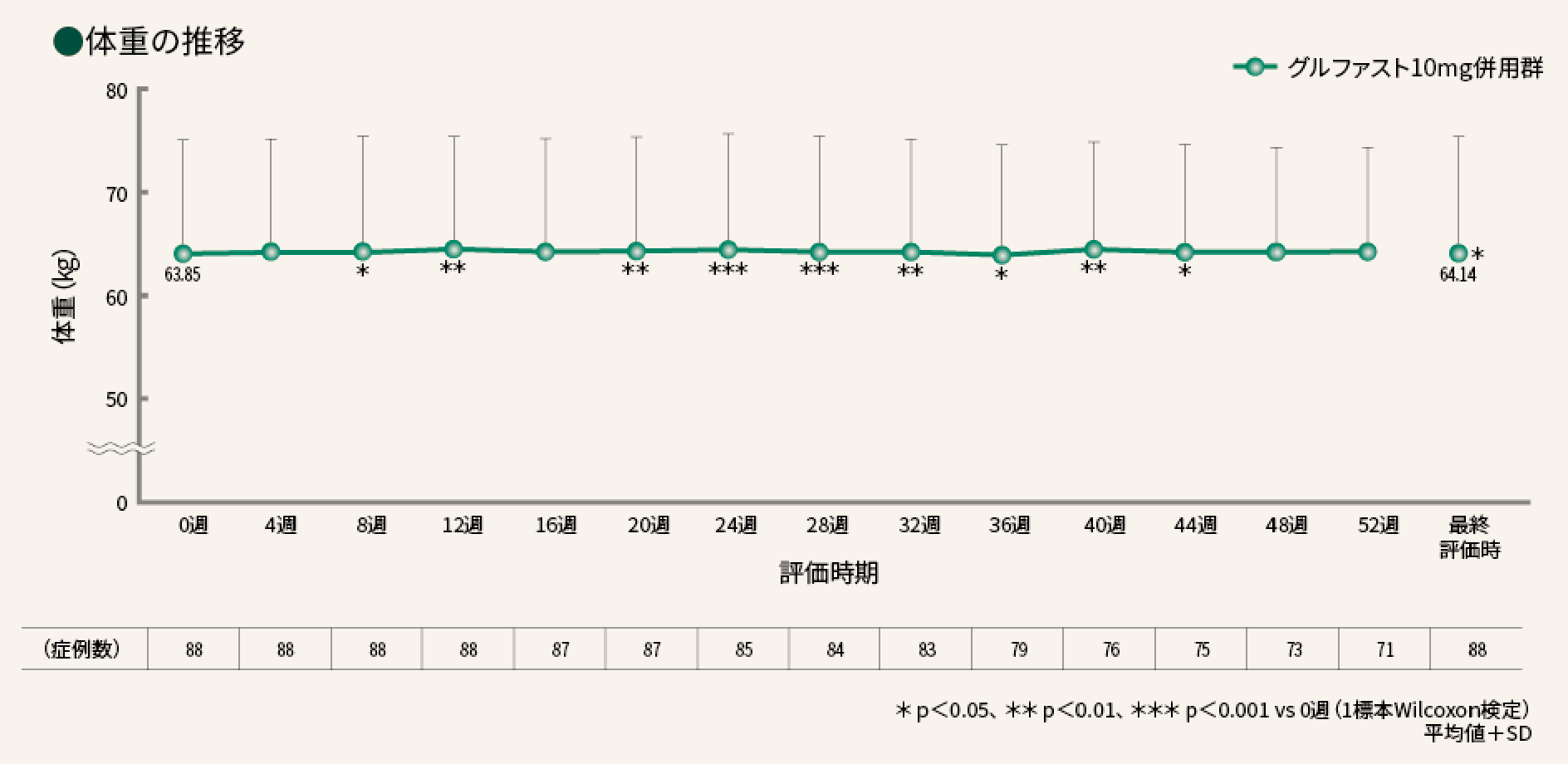
■ 体重の推移
4.効能又は効果
2型糖尿病
ただし、ミチグリニドカルシウム水和物及びボグリボースの併用による治療が適切と判断される場合に限る。
5.効能又は効果に関連する注意(抜粋)
- 5.2本剤を2型糖尿病治療の第一選択薬として用いないこと。
- 5.3原則として、以下の場合に本剤の使用を検討すること。
- 既にミチグリニドカルシウム水和物として1回10mg、1日3回及びボグリボースとして1回0.2mg、1日3回を併用し 状態が安定している場合
- ミチグリニドカルシウム水和物として1回10mg、1日3回の単剤の治療により効果不十分な場合
- ボグリボースとして1回0.2mg、1日3回の単剤の治療により効果不十分な場合
6.用法及び用量
通常、成人には1回1錠(ミチグリニドカルシウム水和物/ボグリボースとして10mg/0.2mg)を1日3回毎食直前に経口投与する。
8.重要な基本的注意(抜粋)
- 8.3本剤投与中は、血糖を定期的に検査するとともに、経過を十分に観察し、本剤を2~3ヵ月投与しても効果が不十分な場合には、より適切と考えられる治療への変更を考慮すること。






