糖尿病合併透析患者の特徴
ー糖尿病合併透析患者の血糖日内変動
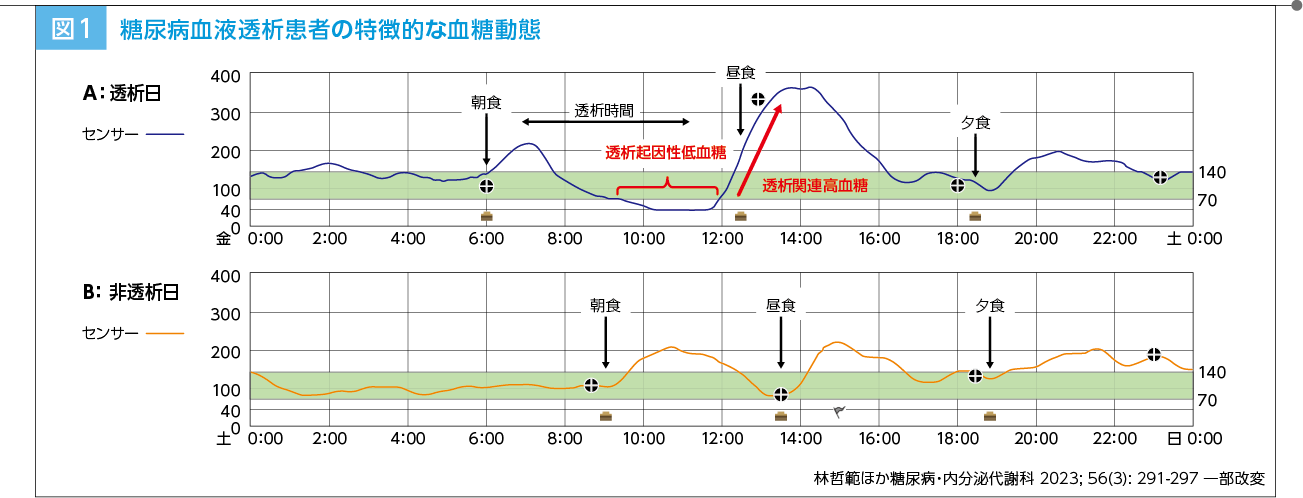
林 「透析患者の糖尿病治療ガイド2025」1)の発刊にあたり、糖尿病合併透析患者の特徴についてみておきたいと思います。まず、特有の血糖日内変動についてです。糖尿病合併透析患者のCGMデータを透析日と非透析日で比較すると、前者(図1上)では透析中から終了後に透析起因性低血糖が、その後の食事摂取によって急峻な血糖上昇(透析関連高血糖)が生じる一方、後者(図1下)ではこれらの現象が観察されませんでした2)。
細島 このような現象は、非糖尿病透析患者でも観察されるのでしょうか。
林 Jinら3)は、糖尿病合併透析患者36例と非糖尿病透析患者10例を対象に、持続グルコースモニタリング(CGM)を用いて72時間にわたる血糖変動を比較しています。その結果、糖尿病合併透析患者群の平均血糖値、標準偏差、平均血糖変動幅はいずれも非糖尿病透析患者群よりも有意に高値であったとしています(p<0.01、t検定およびカイ二乗検定)。したがって、透析日と非透析日の血糖日内変動の差は、糖尿病合併透析患者特異的ではないものの、同患者群でより顕著な現象と考えて差し支えないと思います。
細島 林先生はこの現象の機序をどのように想定していらっしゃいますか。
林 食後の血糖上昇状態で透析を開始すると、血液中のグルコースが透析液中に拡散し除去されます。また、ダイアライザを通過する際に血液中のグルコースが赤血球内に取り込まれ、血糖値が低下する可能性が指摘されています。他方、透析中に血糖値が大きく低下した場合、終了後に著明な血糖値上昇(2025年改訂版1)で透析関連高血糖と定義)を認めることがあります。その機序には、血糖値低下に反応して分泌されるグルカゴン等の血糖調節ホルモンの刺激、ダイアライザによる血清インスリンの吸着/濾過、透析終了後の食事負荷などが考えられます。
細島 グルカゴンも関与しているということですね。
ー糖尿病合併透析患者のエネルギー摂取の現状
細島 透析患者のエネルギー摂取に関する報告4)によれば、透析日のエネルギー摂取量が非透析日よりも有意に少ないことが示されており(p<0.0001、対応のあるt検定)、糖尿病合併透析患者においても同様の結果が示されました(p<0.0001、対応のあるt検定)。実際、透析日には朝食を抜く患者さんが少なくありませんし、その背景には除水量を減らしたい、検査値を少しでもよくしたいといった思いがあるようです。私たちが2018年に新潟透析医学会に参加している55施設を対象に行った透析中の食事摂取状況に関するアンケート調査5)では、血液透析施行中に食事を摂取している患者は18%であることが判明しました。
林 透析日の食事の抜き方に傾向のようなものはありますか。
細島 まとまったデータはありませんが、①透析前の食事を抜く、②透析後に食事摂取しないまま夜を迎える、③透析直後に食事摂取するものの夕食の量が不足するという3パターンに分類できそうです。ただ、それぞれの割合は不明です。
林 透析日の食事に関しては、透析起因性低血糖の予防の観点では透析中の食事摂取が予防策として挙げられます。
「透析患者の糖尿病治療ガイド2025」主なポイント
ー血糖コントロール指標の変更
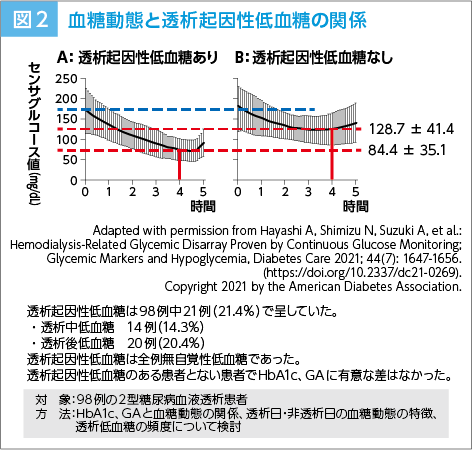
林 今回の改訂のポイントとして、まず血糖コントロールの指標を、2012年版6)で用いていた透析開始前の“随時血糖値(透析前血糖値)”から“透析前血糖値(随時血糖値)”に変更することで、血糖測定のタイミングの明確化を図りました。また、私たちのCGMを用いた観察研究7)において、臨床的意義が明確となった“透析終了時血糖値”を新たな測定推奨項目として記載しました。なおこの観察研究の目的は、100mg/dL超のブドウ糖液を含有する透析液使用時の2型糖尿病合併透析患者群(98例)におけるグルコースプロファイルと、無自覚性低血糖の発現頻度を明らかにすることでした。
その結果、透析起因性低血糖が20%以上の患者に起きており、透析起因性低血糖の有無によるHbA1cおよびグリコアルブミン(GA)、透析前血糖値に差はなかったものの、透析起因性低血糖あり群の透析終了時血糖は、なし群に比較し有意に低値でした(p<0.0001、対応のないStudent t検定; 図2)。この結果を踏まえ、2025年改訂版1)では「透析終了時血糖値90mg/dL未満は透析起因性低血糖のハイリスクとして暫定的に提案する」としています。加えて、CGMを考慮すべき患者像、先述した透析日と非透析日での血糖日内変動プロファイルの違いについて追記しました。
細島 林先生のご研究で、透析起因性低血糖例がすべて無自覚性低血糖であった点は興味深いですね。糖尿病合併透析患者に生じる無自覚性低血糖の頻度を全国レベルで明らかにする研究を行えればと思います。
ー血糖測定の頻度とタイミング
林 表11)に、血糖コントロール目的に使用している薬剤の低血糖リスクに応じた頻度とタイミングを示します。治療内容に関わらず、透析開始時と透析終了時の測定を推奨しています。
その頻度は治療内容により異なりますが、低血糖リスクのある薬剤を使用している場合は毎回行うべきと考えます。なお測定方法に関しては、SMBGではなくPOCT(Point of Care Testing)あるいは検査室での血糖値の測定を推奨しています。
糖尿病合併透析患者への薬剤選択について
ーインクレチン関連薬の投与意義
1.DPP-4阻害薬
細島 糖尿病合併透析患者の予後に対する薬剤の影響を評価することは容易ではないのですが、Chanら8)は台湾の国民健康保険データベースから20歳以上の2型糖尿病合併透析患者を抽出し、プロペンシティスコアマッチング法により背景因子を一致させたDPP-4阻害薬使用群と非使用群(各3,375例)における総死亡率、主要心血管イベント(MACE)発生頻度などを比較評価しています。その結果、DPP-4阻害薬使用群の総死亡率、MACE発生頻度、虚血性脳卒中発生頻度はいずれも非使用群に比較し有意に低い(p<0.001、p=0.001、p=0.024)ことが判明し、DPP-4阻害薬の使用により総死亡は57%、MACEについては24%のリスク低減が得られることが示されました。
では、DPP-4阻害薬による予後改善効果の理由は何か。この疑問を解明するために、私たちは2型糖尿病合併透析患者31例(DPP-4阻害薬使用15例/非使用16例)を対象とした前向き探索的観察研究9)をデザインし、CGMによって捉えた血糖プロファイルについて線形混合効果モデルを用いた解析を試みました。その結果、DPP-4阻害薬使用群は非使用群に比較して24時間の血糖変動幅が小さく、血液透析中の血糖値低下や特に夜間低血糖の改善がみられることがわかりました。この結果について私たちは、透析中/透析後の夜間血糖変動の抑制が、DPP-4阻害薬使用による予後改善効果の理由ではないかと考えています。
林 重要な知見です。先生が想定されている血糖変動幅の縮小も含めて、DPP-4阻害薬の糖尿病合併透析患者の予後改善機序を解明していく必要があると思います。
DPP-4阻害薬にはdaily製剤、weekly製剤がありますが、その投与意義についてはいかがでしょうか。
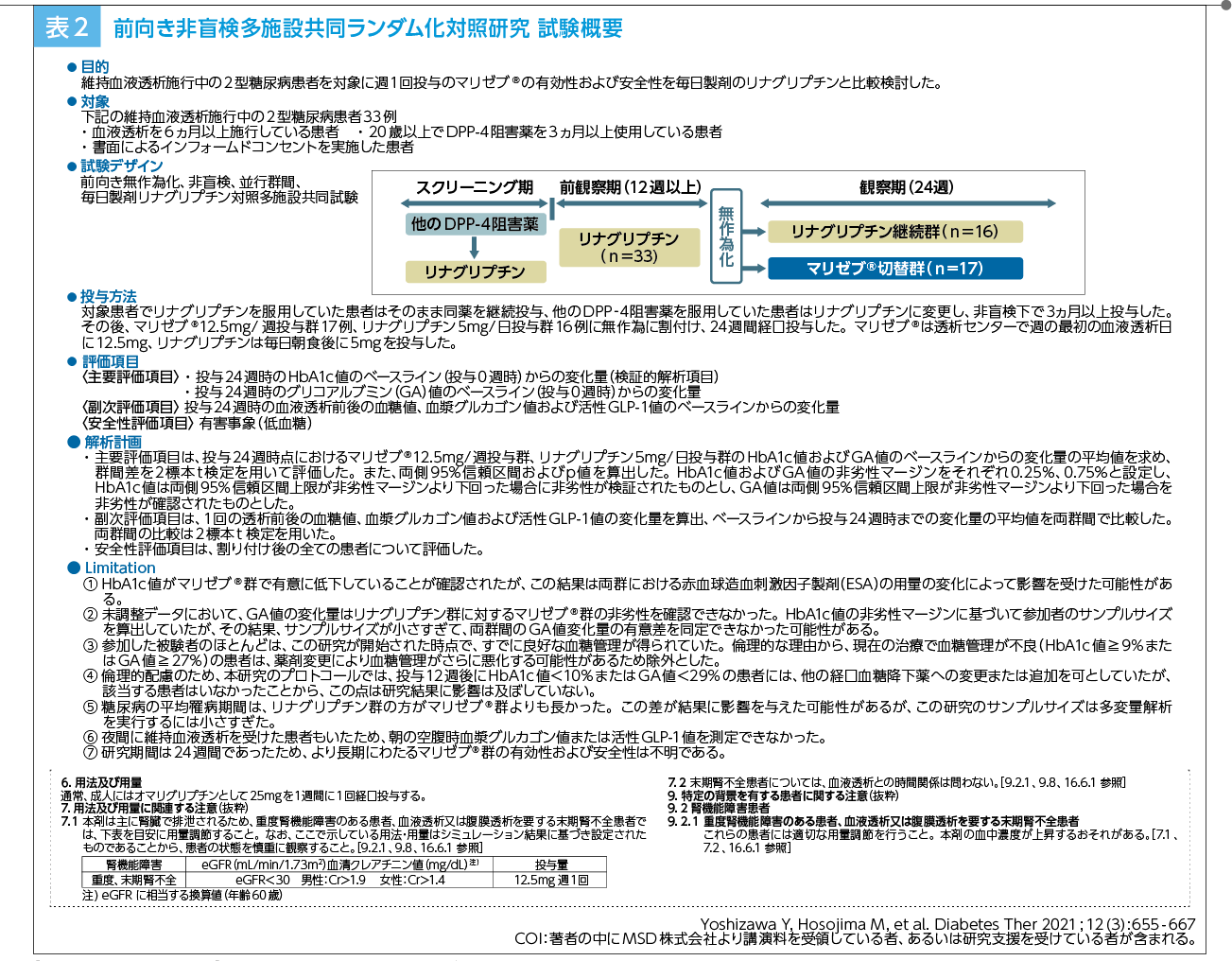
細島 私たちの行った前向き非盲検多施設共同ランダム化対照研究10)があります(表2)。この研究は、daily製剤(リナグリプチン)に対するweekly製剤(マリゼブ)の非劣性の検証を目的に行われました。
リナグリプチンの投与を3ヵ月以上にわたって受けていた2型糖尿病合併透析患者33例を、同剤を継続するdaily製剤群とマリゼブに切り替えるweekly製剤群に1:1で無作為割りつけし、主要評価項目に両群の24週時のHbA1cおよびGAのベースラインからの変化量を、副次的評価項目に24週時の血液透析前後の血糖値、血漿グルカゴン値および活性GLP-1値のベースラインからの変化量を設定しました。
その結果、HbA1cについては群間差-0.61%(95%信頼区間:-1.14 to -0.09)であり、95%信頼区間の上限値が非劣性マージン0.25%を下回ったため、マリゼブのリナグリプチンに対する非劣性が検証されました(検証的解析結果)。投与24週時におけるHbA1c値のベースラインからの変化量は、マリゼブ12.5mg/週群が-0.2±0.6、リナグリプチン5mg/日群が0.4±0.8でした。また、GA値については群間差-1.67%(95%信頼区間:-4.23 to +0.88)であり、95%信頼区間の上限値が非劣性マージン0.75%を上回ったため、マリゼブのリナグリプチンに対する非劣性は確認されませんでした。投与24週時におけるGA値のベースラインからの変化量は、マリゼブ12.5mg/週群が−0.3±3.4、リナグリプチン5mg/日群が1.4±3.4でした。また、透析後の血糖値の変化量(副次評価項目)は、リナグリプチン5mg/日群 25.2±59.5に比し、マリゼブ12.5mg/週群で−18.4±31.4と有意な低下が示されました(p=0.019、名目上のp値、2標本t検定)。加えて、マリゼブ群では低血糖等の副作用は認められませんでした。リナグリプチン5mg/日群では低血糖が1例に認められたため、投与を中止しました。(※マリゼブの安全性についてはDrug Informationをご参照ください)
林 Weekly製剤のdaily製剤に対する非劣性が2型糖尿病合併透析患者群を対象に検証されただけでなく、HbA1cやGAの変化量からすると、血糖コントロールの改善も期待できそうですね。
細島 週1回の服用を透析室で厳格に管理できることも影響していると思います。
2.GLP-1受容体作動薬
林 次は、もう1種類のインクレチン関連薬であるGLP-1受容体作動薬の投与意義です。私たちは肥満および2型糖尿病合併透析患者11例(男/女=7/4、平均年齢57±10歳、平均BMI 30.8±3.2kg/m2)を対象に、weeklyのGLP-1受容体作動薬注射製剤セマグルチドの有効性と安全性を評価しました11)。まず、6ヵ月後のHbA1cおよびGAはいずれも有意な改善が認められました(p=0.0318、p=0.0062、対応のあるt検定)。CGMを用いて透析日と非透析日の血糖プロファイルを比較した結果、変動係数(%CV)は32.8±11.0%からフォローアップ終了時には30.4±6.5%に変化しましたが、有意差はありませんでした(p=0.3933)。Dry weightは6ヵ月間で中央値2.5kg、有意な減少を示しました(p=0.0285、対応のあるt検定)。以上の結果からGLP-1受容体作動薬セマグルチドは、肥満のある2型糖尿病合併透析患者の血糖コントロールおよび体重管理において安全かつ有効な選択肢のひとつと結論づけました。
細島 私たちはデュラグルチドの有効性と安全性について検討12)しましたので、その概要を紹介します。対象はインスリン療法中の2型糖尿病合併透析患者12例です。CGMを用いて平均血糖値、標準偏差、平均血糖変動幅、透析前血糖値を算出、その他、GA、HbA1c、ベースラインからの1日総インスリン投与量の変化、治療満足度、患者QOLを評価しました。その結果、GA(p=0.026、Wilcoxon符号順位検定)と1日総インスリン投与量(p=0.002、Wilcoxon符号順位検定)が低血糖の発生を増やすことなく有意に低下あるいは減少し、4例でインスリン療法からの離脱に成功しました。
ーインクレチン関連薬の経口製剤と注射製剤の使い分け
林 糖尿病治療ガイド改訂ワーキンググループのメンバーとしては、まずDPP-4阻害薬が第一選択薬と考えていただくことを望みます。その上で、daily製剤とweekly製剤のいずれを選ぶかについては、内服管理を透析室で遂行できるのであれば、患者/家族負担の軽減という意味でweekly製剤を勧めます。では、経口製剤と注射製剤の使い分けをどうするか。後者はGLP-1受容体作動薬となりますが、35kg/m2を超えるようなBMI高値、あるいは透析間体重が増加しやすい糖尿病合併透析患者には適していると考えています。
細島 DPP-4阻害薬は血糖変動幅を抑制し、患者によっては低血糖を起こしにくくすると考えられますので、同意します。
林 日本人の場合は概して肥満を来しにくく、今述べたようなBMI高値例は稀ですから、血糖変動幅を縮小でき低血糖発生リスクが低いDPP-4阻害薬から開始することは理に適っていると思います。
ー経口薬の多剤併用問題と注射製剤の侵襲性
細島 以前より透析患者では薬の多剤併用が問題とされており、平成25年度厚生労働省保険局医療課委託調査の「薬局の機能に係る実態調査」13)では、半数以上の患者が残薬を経験していることが示されていました。
林 DPP-4阻害薬をdaily製剤からweekly製剤に切り替えて血糖コントロールが改善したときに、「今までは飲めていなかったでしょう」といってはなりません。患者さんとの関係性が一気に悪化してしまいます。
細島 口に出さずに、アドヒアランスが悪かったのかと患者さんの状況に思いを馳せるということでしょうか。他方、注射製剤の侵襲性は明らかで、打ちたいという患者さんはいないでしょう。インスリンも含めてどのように注射回数を減らすかを考える必要があります。
糖尿病合併透析患者の診療上の課題と展望
林 いくつかの研究を紹介しましたが、CGMは実臨床においても効果的だと考えます。ただ、透析施設で積極的に行うというのではなく、急激な血糖変動を起こす患者さんを経験した際にCGMが可能な糖尿病専門施設に紹介し、詳細な血糖変動プロファイルを把握した上で、透析療法やライフスタイルの見直し等に活かすことを勧めます。
細島 栄養指導が糖尿病合併透析患者に対する重要な治療法だということを認識して、食事を重視してほしいと思います。BMIを指標にエネルギー摂取/消費バランスを整えます。その際、低栄養が認められる患者さんにおいては、少しでもエネルギー摂取量を増やす方向で指導をしていただきたいと思います。方法としては、食事全体の量を増やす、経口栄養補助食品(ONS)を活用する、透析時経静脈栄養法を実践するといったものが挙げられます。
林 CGMの話で触れましたが、糖尿病合併透析患者のマネジメントは糖尿病専門医を巻き込む形で、透析医と透析室スタッフの三者が連携して行う必要があります。本日はありがとうございました。
- 1)
- 日本透析医学会「透析患者の糖尿病治療ガイド2025」医学図書出版2025
- 2)
- 林哲範ほか 糖尿病・内分泌代謝科 2023; 56(3): 291-297
- 3)
- Jin YP, et al. J Diabetes Complications 2015; 29(3): 395-399
- 4)
- Burrowes JD, et al. J Ren Nutr 2003; 13(3): 191-198
- 5)
- 蒲澤秀門ほか 腎と透析 2019; 86(6): 754-757
- 6)
- 日本透析医学会「血液透析患者の糖尿病治療ガイド2012」透析会誌 2013: 46(3): 311-357
- 7)
- Hayashi A, et al. Diabetes Care 2021; 44(7): 1647-1656
- 8)
- Chan SY, et al. Int J Cardiol 2016; 218: 170-175
- 9)
- Ishikawa-Tanaka T, et al. Diabetes Ther 2020; 11(12): 2845-2861
- 10)
- Yoshizawa Y, et al. Diabetes Ther 2021; 12(3): 655-667
- 11)
- Hayashi A, et al. Ren Replace Ther 2025; 11: 32
- 12)
- Ugamura D, et al. Ren Replace Ther 2022; 8: 26
- 13)
- 平成25年度厚生労働省保険局医療課委託調査「薬局の機能に係る実態調査」(速報値)